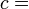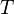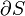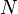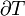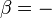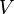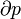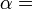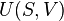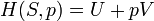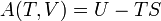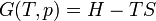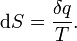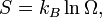Introduction à l'entropie
Renseignements généraux
Enfants SOS offrent un chargement complet de la sélection pour les écoles pour une utilisation sur les intranets des écoles. Visitez le site Web d'enfants SOS au http://www.soschildren.org/
| Thermodynamique | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Le moteur thermique classique Carnot | |||||||||||||||||||||
Branches | |||||||||||||||||||||
Systèmes État: Équation d'état Idéal gaz · Gaz réel Phase de matière · Équilibre Contrôle du volume · Instruments Processus: Isobarique · Isochore · Isothermal Adiabatique · Isentropique · Isenthalpique Quasistatique · Polytropic Libre dilatation Réversibilité · Irréversibilité Endoreversibility Cycles: Les moteurs thermiques · Pompes à chaleur L'efficacité thermique | |||||||||||||||||||||
Propriétés système diagrammes de propriété Propriétés intensives et extensives Fonctions d'Etat: Température / entropie (intro.) † Pression / Volume † Potentiel chimique / Particule non. † († Variables conjuguées) La qualité de vapeur Propriétés réduits fonctions du processus: Travail · Heat |
|||||||||||||||||||||
Propriétés des matériaux
| |||||||||||||||||||||
Équations Le théorème de Carnot · Clausius théorème · Relation fondamentale · Loi des gaz parfaits · Relations de Maxwell · Relations réciproques Onsager · Équations thermodynamiques de Bridgman Table des équations thermodynamiques | |||||||||||||||||||||
Potentiels L'énergie gratuite · Entropie gratuit
| |||||||||||||||||||||
Histoire et culture Philosophie: Entropie et l'heure · Entropie et de la vie Cliquet brownien Le démon de Maxwell la mort de chaleur paradoxe Le paradoxe de Loschmidt Synergetics Histoire: Général · Chaleur · Entropy · lois de gaz Mouvement perpétuel Théories: Théorie du calorique · Vis viva Théorie de la chaleur Équivalent mécanique de la chaleur La force motrice Publications: " Un expérimentale ... Enquête sur l'Heat " " Sur l'équilibre des substances hétérogènes " "Réflexions sur la Motive Power of Fire " Échéanciers de: Thermodynamique · Les moteurs thermiques Art: Surface thermodynamique de Maxwell Éducation: Entropie dispersion d'énergie | |||||||||||||||||||||
L'entropie est une mesure de la façon dont l'énergie est uniformément répartie dans un système. Dans une entropie physique du système fournit une mesure de la quantité d'énergie qui ne peut être utilisé pour faire le travail .
Lorsque la chaleur se écoule d'une région chaude à une région froide entropie augmente, car la chaleur est distribuée dans tout le système. Le concept de l'entropie est au cœur de la seconde loi de la thermodynamique . La deuxième loi détermine quels processus physiques peuvent se produire. Par exemple, il prévoit que les flux de chaleur de haute température à basse température dans des processus spontanés. La deuxième loi de la thermodynamique peut être déclaré comme disant que l'entropie d'un système isolé augmente toujours, et les processus qui augmentent l'entropie peut se produire spontanément. Depuis entropie augmente l'uniformité augmente, la seconde loi dit qualitativement que l'uniformité des augmentations.
Le terme a été inventé entropie en 1865 par le physicien allemand Rudolf Clausius, des mots grecs EN-, "in", et trope "un tournant", par analogie avec l'énergie .
Explication
Le concept de l'entropie thermodynamique découle de la seconde loi de la thermodynamique . Il utilise l'entropie de quantifier la capacité d'un système de changement, à savoir que les flux provenant d'une région de température supérieure à une température inférieure à la chaleur, et à déterminer si un processus thermodynamique peut se produire.
L'entropie est définie par deux descriptions, comme première relation macroscopique entre le flux de chaleur dans un système et le changement de température dans le système, et d'autre part, à un niveau microscopique, comme le logarithme naturel du nombre de microétats d'un système.
Après le formalisme de Clausius, la première définition peut être mathématiquement a déclaré que:
Où D S est la variation de l'entropie et q δ est la chaleur ajoutée au système réversible. Si la température est autorisée à varier l'équation doit être intégrée sur le chemin de la température. Cette définition de l'entropie ne permet pas la détermination d'une valeur absolue, uniquement des différences.
La deuxième définition de l'entropie vient de la mécanique statistique . L'entropie d'un particulier macroscopique est défini comme étant Boltzmann constante fois le logarithme naturel du nombre de micro-correspondant à celle macroscopique ou mathématique
Où S est l'entropie, k est la constante de Boltzmann, et oméga est le nombre de micro-états.
Le macroétat d'un système est ce que nous savons sur le système, par exemple la température , pression, et volume d'un gaz dans une boîte. Pour chaque ensemble de valeurs de la température, la pression, le volume et il existe de nombreux agencements des molécules qui donnent lieu à ces valeurs. Le nombre d'arrangements de molécules qui pourraient entraîner les mêmes valeurs pour la température, la pression et le volume est le nombre de micro.
Le concept de l'énergie est liée à la première loi de la thermodynamique , qui traite de la conservation de l'énergie et dans lequel la perte de chaleur se traduira par une diminution de la l'énergie de la système thermodynamique. Entropie thermodynamique fournit une mesure comparative de la quantité de cette diminution de l'énergie interne du système et l'augmentation correspondante de l'énergie de l'environnement à une température donnée. Une visualisation simple et plus concrète de la deuxième loi est que l'énergie de tous les types de changements étant localisée à se disperser ou étalée, se il ne est pas gêné de le faire. Changement entropie est la mesure quantitative de ce genre d'un processus spontané: combien d'énergie a coulé ou comment il est devenu largement propagé à une température spécifique.
L'entropie a été développé pour décrire un quelconque de plusieurs phénomènes, en fonction du champ et du contexte dans lequel il est utilisé. Informations entropie prend les concepts mathématiques de la thermodynamique statistique dans les domaines de la théorie des probabilités sans rapport avec la chaleur et de l'énergie.

Exemple d'augmenter l'entropie
fonte de la glace fournit un exemple dans lequel l'entropie augmente dans un petit système, un système thermodynamique constitué de l'environnement (la pièce chaude) et l'entité du récipient en verre, de la glace, de l'eau qui a été autorisé à rejoindre l'équilibre thermodynamique à la température de fusion de la glace. Dans ce système, certains chaleur (AQ) des environs chauds à 298 K (77 ° F, 25 ° C) les transferts vers le système de refroidissement de la glace et de l'eau à sa température constante (T) de 273 K (32 ° F, 0 ° C), la température de fusion de la glace. L'entropie du système, qui est AQ / T, augmente de AQ / 273K. L'AQ de chaleur pour ce processus est l'énergie nécessaire pour changer l'eau de l'état solide à l'état liquide, et est appelée la enthalpie de fusion, ce est-AH pour la fusion de la glace.
Il est important de réaliser que l'entropie de la salle environnante diminue moins de l'entropie de la glace et l'eau augmente: la température ambiante de 298 K est supérieur à 273 K et donc le rapport, (changement d'entropie), d'AQ / 298K pour l'environnement est plus petit que le rapport (changement d'entropie), de AQ / 273K pour le système de glace et d'eau. Ce est toujours le cas dans les événements spontanés dans un système thermodynamique et il montre l'importance prédictive de l'entropie: l'entropie net final après un tel événement est toujours plus grande que ne l'était l'entropie initiale.
Comme la température de l'eau fraîche se élève à celui de la chambre et la salle refroidit encore imperceptiblement, la somme de l'AQ / T sur la plage continue, "à de nombreux incréments", dans l'eau chaude enfin initialement cool peut être trouvée par calcul. La miniature toute «univers», ce est à dire ce système thermodynamique, l'entropie a augmenté. Energy a spontanément devenir plus dispersée et se propager à cet «univers» que lorsque le verre de glace + eau a été introduite et est devenu un «système» en son sein.
Origines et utilisations
À l'origine, l'entropie a été nommé pour décrire la chaleur perdue, ou plus exactement les pertes d'énergie, de moteurs thermiques et autres dispositifs mécaniques qui ne pourrait jamais fonctionner avec 100% d'efficacité dans la conversion de l'énergie dans le travail. Plus tard, le terme est venu à acquérir plusieurs descriptions supplémentaires comme plus venu à être compris sur le comportement des molécules à l'échelle microscopique. Dans la fin du 19e siècle, le mot «trouble» a été utilisé par Ludwig Boltzmann dans le développement vues statistiques de l'entropie en utilisant la théorie des probabilités pour décrire le mouvement moléculaire accru à l'échelle microscopique. Ce était avant l'arrivée de comportement quantique d'être mieux compris par Werner Heisenberg et ceux qui ont suivi. Descriptions de thermodynamique (chaleur) entropie au niveau microscopique se trouvent dans la thermodynamique statistique et mécanique statistique .
Pour la plupart du 20e siècle manuels ont tendance à décrire l'entropie comme «désordre», à la suite conceptualisation début de Boltzmann de l'énergie de mouvement de molécules. Plus récemment, il ya eu une tendance en chimie et physique des manuels pour décrire entropie en termes de "la dispersion de l'énergie". Entropie peut également impliquer la dispersion des particules, qui sont eux-mêmes énergique. Ainsi il ya des cas où les deux particules et de l'énergie se dispersent à des vitesses différentes lorsque les substances sont mélangées.
Les mathématiques développés en thermodynamique statistique n'a été observée pour être applicable dans d'autres disciplines. En particulier, sciences de l'information ont développé le concept de l'entropie de l'information où une constante remplace la température qui est inhérente à entropie thermodynamique.
La chaleur et l'entropie
Au niveau microscopique, l'énergie cinétique des molécules est responsable de la température d'une substance ou un système. "Heat" est l'énergie cinétique des molécules d'être transféré: lorsque l'énergie de mouvement est transférée à partir alentours chaudes à un système de refroidissement, les molécules se déplaçant plus rapidement dans les environs entrent en collision avec les parois du système qui transfère une partie de leur énergie aux molécules du système et les rend déplacent plus rapidement.
- Molécules dans un gaz comme l'azote à la température ambiante à tout instant se déplacent à une vitesse moyenne de près de 500 miles par heure (210 m / s), se heurtant à plusieurs reprises et donc échanger de l'énergie de sorte que leurs vitesses individuelles sont toujours en train de changer, même en étant immobile un instant si deux molécules avec exactement la même vitesse se heurtent de front, avant une autre molécule les frappe et ils se élancer, aussi vite 2500 miles à l'heure. (A des températures plus élevées augmentent la vitesse moyenne et de l'énergie de mouvement devient proportionnellement plus.)
- Énergie moléculaire Ainsi de mouvement («d'énergie thermique ') à partir environnement plus chauds, comme des molécules plus rapide se déplaçant dans une flamme ou vibrant violemment atomes de fer dans une assiette chaude, va fondre ou de faire bouillir une substance (le système) à la température de sa fusion ou point d'ébullition . Cette quantité d'énergie de mouvement provenant de l'environnement qui est nécessaire pour la fusion ou l'ébullition est appelée l'énergie de changement de phase, notamment l'enthalpie de fusion ou de vaporisation, respectivement. Cela rompt d'énergie de changement de phase liaisons entre les molécules dans le système (pas de liaisons chimiques à l'intérieur des molécules qui maintiennent les atomes ensemble) plutôt que de contribuer à l'énergie de mouvement et de rendre les molécules se déplacent plus vite - de sorte qu'il ne soulève pas la température, mais permet au lieu de briser les molécules libres de se déplacer sous forme de liquide ou sous forme de vapeur.
- En termes d'énergie, quand un solide devient un liquide ou un liquide vapeur, l'énergie de mouvement venant de l'environnement est remplacée par «énergie potentielle» dans la substance (énergie et le changement de phase, qui est remis à l'environnement lorsque l'environnement devient refroidisseur de point d'ébullition ou la température de fusion de la substance, respectivement). le changement de phase de l'énergie augmente l'entropie d'une substance ou d'un système, car ce est l'énergie qui doit être étalée dans le système de l'environnement de sorte que la substance peut exister sous forme liquide ou vapeur à une température supérieure à son point de fusion ou d'ébullition. Lorsque ce processus se produit dans un «univers» qui se compose de l'environnement ainsi que le système, l'énergie totale de l'univers devient plus dispersé ou étalée dans le cadre de la plus grande énergie qui ne est que dans les environs transferts plus chauds de sorte que certains est dans le système de refroidissement. Cette dispersion d'énergie augmente l'entropie du «univers».
Le principe général important est que "l'énergie de tous les types de change étant localisée à se disperser ou étalée, se il ne est pas gêné de le faire. Entropie (ou mieux, le changement entropie) est la mesure quantitative de ce genre d'un processus spontané: combien d'énergie a été transférée / T ou comment il est devenu largement propagé à une température spécifique.
Calcul classique de l'entropie
Lorsque l'entropie a été défini et utilisé en 1865 l'existence même d'atomes était encore controversée et il n'y avait pas de concept que la température était due à l'énergie de mouvement de molécules ou «chaleur» a été en fait le transfert de cette énergie moléculaire de mouvement d'un endroit à un autre. Entropy changement, 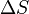 , A été décrite en termes macroscopiques qui peuvent être mesurées directement, comme le volume, la température ou la pression. Cependant, aujourd'hui, l'équation classique de l'entropie,
, A été décrite en termes macroscopiques qui peuvent être mesurées directement, comme le volume, la température ou la pression. Cependant, aujourd'hui, l'équation classique de l'entropie, 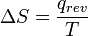 peut être expliqué, partie par partie, en termes modernes décrivant comment molécules sont responsables de ce qui se passe:
peut être expliqué, partie par partie, en termes modernes décrivant comment molécules sont responsables de ce qui se passe:
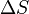 est le changement de l'entropie d'un système (certains de substance physique d'intérêt) après un peu d'énergie de mouvement («chaleur») a été transférée par des molécules en mouvement rapide. Alors,
est le changement de l'entropie d'un système (certains de substance physique d'intérêt) après un peu d'énergie de mouvement («chaleur») a été transférée par des molécules en mouvement rapide. Alors, 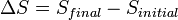 .
.
- Ensuite,
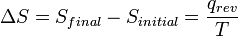 , Le quotient de l'énergie de mouvement ("thermique") q qui est transféré «réversible» (Ap) au système à partir de l'environnement (ou d'un autre système en contact avec le premier système) divisé par T, la température absolue à laquelle la transfert a lieu.
, Le quotient de l'énergie de mouvement ("thermique") q qui est transféré «réversible» (Ap) au système à partir de l'environnement (ou d'un autre système en contact avec le premier système) divisé par T, la température absolue à laquelle la transfert a lieu. - "Réversible" ou "réversible" (rev) signifie simplement que T, la température du système, doit rester (presque) exactement le même pendant toute l'énergie est transférée vers ou à partir de lui. Ce est facile dans le cas de changements de phase, où le système doit absolument rester dans la forme solide ou liquide jusqu'à ce que suffisamment d'énergie est donné à elle pour rompre les liaisons entre les molécules avant de pouvoir passer à un liquide ou un gaz. Par exemple, dans la fonte des glaces à 273,15 K, ne importe quelle température les environs sont - à partir de 273,20 K à 500 K ou même plus, la température de la glace restera à 273,15 K jusqu'à ce que les dernières molécules dans la glace sont changés en liquide l'eau, des liaisons hydrogène-à-dire, jusqu'à ce que toutes les liaisons hydrogène entre les molécules d'eau dans la glace sont cassé et nouvelle, moins exactement fixes entre les molécules d'eau liquide sont formés. Cette quantité d'énergie nécessaire à la fusion de la glace par mole a été trouvé pour être 6008 joules à 273 K. Par conséquent, le changement d'entropie est par mole
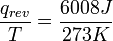 , Ou 22 J / K.
, Ou 22 J / K. - Lorsque la température ne est pas au point d'une substance fusion ou d'ébullition aucun lien-rupture intermoléculaires est possible, et donc toute l'énergie de mouvement moléculaire («chaleur») des environs transférés à un système élève sa température, ce qui rend ses molécules se déplacent plus rapidement et plus rapide. Lorsque la température est en constante augmentation, il n'y a plus une valeur particulière de «T» à laquelle l'énergie est transférée. Toutefois, un transfert d'énergie «réversible» peut être mesuré à une très faible augmentation de la température, et un total cumulé peut être trouvé en additionnant chacun des nombreux intervalles de température ou petits incréments. Par exemple, pour trouver le changement entropie
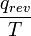 de 300 K à 310 K, mesurer la quantité d'énergie transférée à des dizaines ou des centaines de incréments de température, disons de 300,00 K à 300,01 K et 300,01 à 300,02 et ainsi de suite, divisant le q par chaque T, et enfin tous ajoutant.
de 300 K à 310 K, mesurer la quantité d'énergie transférée à des dizaines ou des centaines de incréments de température, disons de 300,00 K à 300,01 K et 300,01 à 300,02 et ainsi de suite, divisant le q par chaque T, et enfin tous ajoutant. - Calcul peut être utilisée pour faire ce calcul plus facile si l'effet de l'apport d'énergie au système est linéairement dépendant de la variation de température, comme dans un simple chauffage du système à des températures modérées à relativement élevé. Ainsi, l'énergie étant transférée »par un changement progressif de la température» (la capacité thermique,
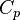 ), Multiplié par le intégrante de
), Multiplié par le intégrante de 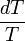 à partir de
à partir de 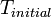 à
à 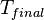 , Est directement donné par
, Est directement donné par 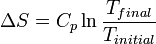 .
.
- "Réversible" ou "réversible" (rev) signifie simplement que T, la température du système, doit rester (presque) exactement le même pendant toute l'énergie est transférée vers ou à partir de lui. Ce est facile dans le cas de changements de phase, où le système doit absolument rester dans la forme solide ou liquide jusqu'à ce que suffisamment d'énergie est donné à elle pour rompre les liaisons entre les molécules avant de pouvoir passer à un liquide ou un gaz. Par exemple, dans la fonte des glaces à 273,15 K, ne importe quelle température les environs sont - à partir de 273,20 K à 500 K ou même plus, la température de la glace restera à 273,15 K jusqu'à ce que les dernières molécules dans la glace sont changés en liquide l'eau, des liaisons hydrogène-à-dire, jusqu'à ce que toutes les liaisons hydrogène entre les molécules d'eau dans la glace sont cassé et nouvelle, moins exactement fixes entre les molécules d'eau liquide sont formés. Cette quantité d'énergie nécessaire à la fusion de la glace par mole a été trouvé pour être 6008 joules à 273 K. Par conséquent, le changement d'entropie est par mole
Les descriptions liminaires de l'entropie
Traditionnellement, les manuels 20e siècle ont introduit entropie comme ordre et le désordre de sorte qu'il fournit "une mesure du trouble ou d'un système aléatoire". Il a été avancé que les ambiguïtés dans les termes utilisés (tels que «désordre» et «chaos») contribuent à la confusion généralisée et peuvent entraver la compréhension de l'entropie pour la plupart des étudiants. Une formulation plus récente associée à Frank L. Lambert décrivant entropie dispersion d'énergie décrit entropie que la mesure "la dispersion spontanée de l'énergie - à une température spécifique."