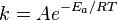A energia de ativação
Informações de fundo
Crianças SOS têm produzido uma seleção de artigos da Wikipédia para escolas desde 2005. Você quer saber sobre o patrocínio? Veja www.sponsorachild.org.uk

Em química , a energia de ativação é um termo introduzido em 1889 pelo cientista sueco Svante Arrhenius que é definida como a energia mínima que deve ser entrada para um sistema de química, contendo potenciais reagentes, a fim de que uma reacção química ocorra. Energia de activação podem também ser definida como a energia mínima necessária para iniciar uma reacção química. A energia de activação de uma reacção é geralmente indicado por um E e dado em unidades de quilojoules por mole.
Energia de activação pode ser pensada como a altura do barreira de potencial (por vezes chamado a barreira de energia) que separa dois mínimos de energia potencial (dos reagentes e produtos de reacção) de uma. Para obter uma reacção química prossiga a uma taxa razoável, deve existir um número significativo de moléculas com energia igual a ou maior do que a energia de activação.
A um nível mais avançada, o termo energia Activação de Arrhenius a partir da equação de Arrhenius é melhor considerada como um parâmetro determinado experimentalmente que indica a sensibilidade da velocidade de reacção para a temperatura. Há duas objeções a associar esta energia de ativação com a barreira de limite para uma reação elementar. Em primeiro lugar, nem sempre é claro quanto à existência ou não de reação se processa em uma única etapa; barreiras de limiar que são distribuídos por todas as etapas elementares têm pouco valor teórico. Em segundo lugar, mesmo se a reacção a ser estudado é elementar, um espectro de colisões individuais contribui para avaliar as constantes obtidas a partir de grandes quantidades ("bulb") experiências envolvendo milhares de milhões de moléculas, com muitas geometrias e ângulos de colisão diferentes reagente, diferente translacionais e (possivelmente) vibracionais energias - todos os quais podem conduzir a diferentes taxas de reacção microscópicas.
Energia de ativação negativa
Em alguns casos, velocidades de reacção diminuem com o aumento da temperatura. Quando se segue uma relação aproximadamente de modo exponencial a constante de velocidade pode ainda estar apto para uma expressão de Arrhenius, isto resulta num valor negativo de E um. Reacções elementares que exibem estas energias de activação são geralmente reacções negativas barrierless, em que o processo de reacção depende de a captura das moléculas num poço de potencial. O aumento da temperatura conduz a uma reduzida probabilidade de as moléculas de captura que colidem entre si (com mais colisões Glancing não conduzindo a reacção como o maior impulso transporta as partículas que colidem para fora do poço de potencial), expresso como uma reacção secção transversal que diminui com o aumento da temperatura. Tal situação já não leva a interpretações dirigir como a altura de um ponto potencial.
Independência de temperatura e a relação com a equação de Arrhenius
O Equação de Arrhenius dá a base quantitativa da relação entre a energia de activação e a taxa na qual uma reacção prossegue. A partir da equação de Arrhenius, a energia de activação pode ser expressa como
em que A é a factor de frequência para a reacção, o símbolo R representa o universal constante do gás, T é a temperatura (em Kelvin ), e K é a velocidade de reacção coeficiente. Enquanto esta equação sugere que a energia de activação é dependente da temperatura, em regimes nos quais a equação de Arrhenius é válida este é cancelada pela dependência da temperatura do coeficiente k. Assim, um E pode ser avaliada a partir do coeficiente de velocidade de reacção a qualquer temperatura (dentro da validade da equação de Arrhenius).
Catálise
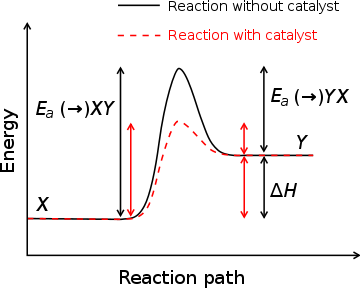
 ) E entalpia de formação (Δ H) com e sem um catalisador, representada graficamente contra a coordenar reacção. A posição mais alta energia (posição do pico) representa o estado de transição. Com o catalisador, a energia necessária para inserir o estado de transição diminui, diminuindo assim a energia necessária para iniciar a reacção.
) E entalpia de formação (Δ H) com e sem um catalisador, representada graficamente contra a coordenar reacção. A posição mais alta energia (posição do pico) representa o estado de transição. Com o catalisador, a energia necessária para inserir o estado de transição diminui, diminuindo assim a energia necessária para iniciar a reacção. Uma substância que modifica o estado de transição para reduzir a energia de activação é denominado um catalisador ; um biológica catalisador é denominado um enzima. É importante notar que um catalisador que aumenta a velocidade de reacção sem ser consumido por ele. Além disso, enquanto que o catalisador reduz a energia de activação, que não altere as energias dos reagentes ou produtos originais. Em vez disso, a energia reagente ea energia do produto permanece o mesmo e apenas a energia de ativação é alterada (reduzido).
Relacionamento com energia livre de Gibbs
No Equação de Arrhenius, o termo energia de activação (Ea) é usado para descrever a energia necessária para alcançar a estado de transição. Da mesma forma, o Eyring equação é uma equação semelhante, que também descreve a velocidade de uma reacção. Em vez de utilizar também um E, no entanto, a equação de Eyring usa o conceito de energia livre de Gibbs e o símbolo * 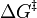 para indicar a energia do estado de transição.
para indicar a energia do estado de transição.