
Distrofia muscular de Duchenne
Sobre este escolas selecção Wikipedia
Esta seleção é feita para as escolas pela caridade infantil leia mais . patrocínio SOS Criança é legal!
| Distrofia muscular de Duchenne | |
|---|---|
| Classificação e recursos externos | |
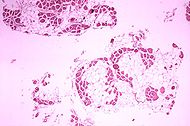 O exame histopatológico do músculo gastrocnêmio de paciente que morreu de distrofia muscular pseudohipertrófica, tipo Duchenne. Seção transversal do músculo mostra extensa substituição das fibras musculares por células adiposas. | |
| CID- 10 | G 71,0 |
| CID- 9 | 359.1 |
| OMIM | 310200 |
| DiseasesDB | 3985 |
| MedlinePlus | 000705 |
| MeSH | D020388 |
Distrofia muscular de Duchenne (DMD) é uma forma recessiva ligada ao X severa distrofia muscular que é caracterizada por uma rápida progressão da degeneração muscular, eventualmente conduzindo a perda de deambulação, paralisia e morte. Esta aflição afeta uma em cada 3.500 homens, tornando-a mais prevalente das distrofias musculares. Em geral, os machos só são atingidas, embora as fêmeas podem ser portadores. A doença é causada por uma mutação no gene DMD, localizado em seres humanos no X cromossomo. O gene DMD para a proteína distrofina, um importante componente estrutural dentro do tecido muscular. A distrofina fornece estabilidade estrutural ao complexo distroglicana (DGC), localizada na membrana celular.
Os sintomas geralmente aparecem em crianças do sexo masculino antes de 6 anos de idade e pode ser visível na primeira infância. Fraqueza muscular progressiva proximal das pernas e pélvis associadas com uma perda de massa muscular é observada pela primeira vez. Eventualmente, esta fraqueza se espalha para os braços, pescoço e outras áreas. Os primeiros sinais podem incluir pseudohypertrophy (alargamento dos músculos da panturrilha), baixa resistência e dificuldades em pé sem ajuda ou incapacidade de subir escadas. Conforme a doença progride, as experiências de tecido músculo desperdiçando e é eventualmente substituído por gordura e tecido fibrótico ( fibrose). Aos 10, cintas pode ser necessária para auxiliar em uma curta, mas a maioria dos pacientes são dependentes de cadeira de rodas por idade 12. Os sintomas tardios podem incluir o desenvolvimento ósseo anormal que levam a deformidades esqueléticas, incluindo curvatura da coluna vertebral. Devido à deterioração progressiva do músculo, perda de movimento ocorre, eventualmente levando à paralisia. Deficiência intelectual também pode estar presente, mas não piora progressivamente à medida que a criança cresce. A esperança média de vida para os pacientes que sofrem com DMD varia de início da adolescência para a idade meados 30s. Há relatos de pacientes com DMD sobreviventes após a idade de 40 e até mesmo 50.
Incidência / prevalência
Distrofia muscular de Duchenne é causada por mutações no gene DMD, que está localizado no cromossoma X. Devido a isto, DMD tem uma incidência de 1 em 4000 machos recém-nascidos. As mutações no gene DMD pode ser hereditária ou ocorrer espontaneamente durante a transmissão da linha germinal.
Eponym
DMD é nomeado após o neurologista francês Guillaume Benjamin Amand Duchenne (1806-1875), que primeiro descreveu a doença na década de 1860.
Patogênese
Distrofia muscular de Duchenne é causada por uma mutação do gene da distrofina em lócus Xp21. A distrofina é responsável pela ligação de fibras musculares para a matriz extracelular através de um complexo de proteínas contendo muitas subunidades. A ausência de distrofina permite que o excesso de cálcio para o penetrar sarcolema (membrana celular). Num processo em cascata complexa que envolve várias vias e não é claramente entendida, aumentou o stress oxidativo dentro dos danos celulares da sarcolema, eventualmente, resulta na morte da célula. As fibras musculares sofrer necrose e são finalmente substituídos com adiposo e tecido conjuntivo.
Sintomas
O principal sintoma da distrofia muscular de Duchenne é progressiva fraqueza muscular associada a com a perda de massa muscular musculatura proximal sendo afetada em primeiro lugar, especialmente a pelve e músculos da panturrilha. A fraqueza muscular também ocorre nos braços, pescoço, e outras áreas, mas não tão cedo quanto na metade inferior do corpo. Os sintomas geralmente aparecem antes de 6 anos de idade e pode aparecer já na primeira infância. Fraqueza generalizada e perda de massa muscular primeiro afetando os músculos dos quadris, região pélvica, coxas e ombros. Os vitelos são muitas vezes aumentada. Os outros sintomas físicos são:
- Andar desajeitado (pacientes tendem a andar em suas patas dianteiras, por causa de um aumento do tônus parir)
- Quedas freqüentes
- Fadiga
- Dificuldade com habilidades motoras (corrida, salto, salto)
- Aumento da lordose lombar, levando ao encurtamento dos músculos do quadril-flexor. Isto tem um efeito sobre a postura geral e marcha.
- Contraturas musculares do tendão de Aquiles e isquiotibiais prejudicar a funcionalidade porque as fibras musculares e encurtar fibrose ocorre em tecido conjuntivo
- Progressive dificuldade para caminhar
- Deformidades fibra muscular
- Pseudohypertrophy dos músculos da língua e da panturrilha. O tecido muscular é alargado eventualmente substituído por gordura e tecido conjuntivo, daí o termo pseudohypertrophy.
- Maior risco de comportamento e dificuldades de aprendizagem.
- Eventual perda de capacidade de andar (geralmente com a idade de 12)
- Deformidades esqueléticas (incluindo escoliose em alguns casos)
Sinais e exames
Perda de massa muscular começa nas pernas e pélvis, em seguida, avança para os músculos dos ombros e pescoço, seguidos de perda de músculos do braço e músculos respiratórios. Alargamento músculo da panturrilha (pseudo) é bastante óbvio. Cardiomiopatia pode ocorrer, mas o desenvolvimento de insuficiência cardíaca congestiva ou arritmias (batimentos cardíacos irregulares) é rara.
- A positivo O sinal de Gower reflete o comprometimento mais grave dos músculos extremidades inferiores. A criança ajuda-se a levantar-se com extremidades superiores: em primeiro lugar pelo aumento de ficar em seus braços e joelhos, e, em seguida, "andar" as mãos para cima as pernas para ficar de pé.
- As crianças afetadas geralmente pneu mais facilmente e têm força total menos do que seus pares.
- Da creatina quinase (CPK-MM) níveis no sangue são extremamente elevados.
- Um electromiografia (EMG) mostra que a fraqueza é causada pela destruição dos tecidos musculares em vez de por uma lesão nervos.
- O teste genético pode revelar erros genéticos no gene Xp21.
- Um músculo biópsia ( ou imuno-histoquímica immunoblotting) ou teste genético ( teste de sangue) confirma a ausência de distrofina, embora melhorias em testes genéticos muitas vezes fazem isso desnecessário.
Diagnóstico
Teste de CPK
Se um médico suspeita DMD depois de examinar o menino eles vão usar um CPK ( creatina fosfoquinase) teste para determinar se os músculos estão danificados. Este teste mede a quantidade de CPK no sangue. Na DMD pacientes CPK fugas para fora da célula muscular para a corrente sanguínea, assim, um nível elevado (50 a 100 vezes o normal) confirma que existe uma lesão muscular. Os indivíduos afectados podem ter um valor tão elevado quanto 15.000 a 35,000iu / l (normal = 60iu / l).
Teste de DNA
A isoforma específica do músculo do gene da distrofina é composto por 79 exões, e testes e análise de DNA pode geralmente identificar o tipo específico de mutação da exão ou exões que são afetados. Teste de DNA confirma o diagnóstico na maioria dos casos.
Biópsia muscular
Se falhar o teste de DNA para encontrar a mutação, um teste de biópsia do músculo pode ser realizada. Uma pequena amostra de tecido muscular é extraída e é aplicada uma tinta que revela a presença de distrofina. A ausência completa da proteína indica a condição.
Nos últimos anos vários testes de DNA que têm sido desenvolvidos detectar mais das muitas mutações que causam a doença, e biópsia do músculo não é requerida como muitas vezes para confirmar a presença de Duchenne.
Exames pré-natais
Se um ou ambos os pais são "portadores" de uma condição particular, há um risco de que o nascituro será afetado por essa condição. 'Testes de pré-natal "são realizadas durante a gravidez, para tentar descobrir se o feto (feto) é afetado. Os testes estão disponíveis apenas para algumas doenças neuromusculares. Diferentes tipos de testes de pré-natal pode ser realizado depois de cerca de 10 semanas de gestação. Biópsia de vilosidade coriônica (CVS) pode ser feito em 10-12 semanas, e amniocentese em cerca de 14-16 semanas, enquanto a biópsia da placenta e coleta de sangue fetal pode ser feito em cerca de 18 semanas. Mulheres e / ou casais precisam considerar cuidadosamente qual teste para ter e discutir este assunto com o seu conselheiro genético. Testes mais cedo permitiria rescisão antecipada que provavelmente seria menos traumática para o casal, mas carrega um risco ligeiramente maior de aborto do que mais tarde os testes (cerca de 2%, em oposição a 0,5%).
Tratamento
Não há nenhuma cura conhecida para a distrofia muscular de Duchenne, embora a pesquisa com células-tronco recente está mostrando vectores promissores que podem substituir o tecido muscular danificado. O tratamento é geralmente destinado ao controlo de sintomas para maximizar a qualidade de vida, e incluem o seguinte.
- Corticosteróides, como a e prednisona Deflazacort aumentar a energia e resistência e adiar a severidade de alguns sintomas.
- Suave, não-rangendo atividade física, como natação é incentivada. Inatividade (como repouso) podem piorar a doença do músculo.
- A fisioterapia é útil para manter a força muscular, flexibilidade e função.
- Aparelhos ortopédicos (tais como cintas e cadeiras de rodas) podem melhorar a mobilidade ea capacidade de auto-cuidado. Chaves de perna removível que seguram o tornozelo no lugar durante o sono pode adiar o início do Formulário-encaixe contraturas.
- Suporte respiratório adequado que a doença progride é importante
Prognóstico
Distrofia muscular de Duchenne, eventualmente, afeta todos os músculos voluntários e envolve o coração e os músculos respiratórios em fases posteriores. A expectativa de vida pode variar de final da adolescência para a idade de 35, no entanto, houve pessoas com Duchenne que fizeram isso até aos 40 anos e além. Os recentes avanços na medicina estão estendendo as vidas das pessoas atingidas. Cirurgia Orthapedic para escoliose também estender a vida de alguém com a doença. Todas as pessoas com a doença DMD são afectadas de forma diferente.
Fisioterapia
Os fisioterapeutas estão preocupados com a permitir que as crianças a alcançar seu máximo potencial físico. O seu objectivo é:
- minimizar o desenvolvimento de contraturas e deformidade através do desenvolvimento de um programa de exercícios e alongamentos quando adequado
- antecipar e minimizar outras complicações secundárias de natureza física
- monitorar a função respiratória e aconselhar sobre técnicas para ajudar com exercícios de respiração e métodos de secreções de compensação
Ventilatório mecânico / Assistência Respiração
Volume de Modern " ventiladores / respiradores, "que proporcionam um volume ajustável (quantidade) de ar para a pessoa com cada respiração, são valiosos no tratamento de pessoas com problemas respiratórios relacionados com distrofia muscular. tratamento ventilador pode começar na plena adolescência, quando os músculos respiratórios pode começar a entrar em colapso. No entanto, existem pessoas com a doença em seus 20 anos que não têm nenhuma necessidade de um ventillator.
Se a capacidade vital caiu abaixo de 40 por cento do normal, um volume de ventilador / respirador pode ser utilizado durante as horas de sono, um momento em que a pessoa é mais provável de estar sob ventilação ("hypoventilating"). Hipoventilação durante o sono é determinado por uma história completa de distúrbio do sono com um estudo oximetria e um gás de sangue capilar (Veja Teste de função pulmonar). O ventilador pode exigir um ou endotraqueal tubo de traqueostomia através do qual o ar é directamente entregue, no entanto, para algumas pessoas de entrega através de uma máscara facial é suficiente.
Se a capacidade vital continua a diminuir para menos do que 30 por cento do normal, um volume de ventilador / respirador pode também ser necessário durante o dia para mais assistência. A pessoa gradualmente vai aumentar a quantidade de tempo de utilização do ventilador / respirador durante o dia, conforme necessário. Um tubo de traqueostomia pode ser usado durante o dia e durante o sono, no entanto, a entrega por meio de uma máscara protectora pode ser suficiente. A máquina pode facilmente caber em uma bandeja de ventilador na parte inferior ou traseira de uma cadeira de rodas eléctrica com uma bateria externa para a portabilidade.
Investigação em curso
Promissora investigação está sendo conduzida para encontrar uma terapia capaz de mitigar os efeitos prejudiciais desta aflição. Existem muitos caminhos atualmente sob intensa investigação. Uma avenida é a terapia genética. Estas terapias incluem: haste de substituição de células, exon-skipping, analógico-regulação, e substituição de genes. Outra via é cuidados de suporte que está envolvida no desenvolvimento de medicamentos para evitar-off progressão da doença.
Caule substituição celular
Embora as células estaminais isoladas a partir das células musculares (satélite) têm a capacidade de se diferenciar em miotubos quando injectado directamente no músculo de animais, eles não têm a capacidade de se espalhar por todo sistemicamente. Para efetivamente entregar uma dose terapêutica de um músculo isolado seria necessário injeções diretas para que o músculo a cada 2 mm. Este problema foi contornado usando células-tronco multipotentes outro, denominado pericitos, que estão localizados dentro dos vasos sanguíneos do músculo esquelético. Estas células têm a capacidade de ser entregues sistemicamente e captado por atravessar a barreira vascular. Uma vez passada a vasculatura, pericitos têm a capacidade de fundir e miotubos do formulário. Isto significa que eles podem ser injectados arterialmente, atravessando as paredes arteriais em músculo, onde eles podem diferenciar em músculo pontentially funcional. Estes resultados mostram o potencial para a terapia com células-tronco de DMD. As células derivadas de pericitos seria extraída, cultivadas em cultura, e, em seguida, estas células podem ser injectadas na corrente sanguínea onde se poderia navegar para dentro e para diferenciar em músculo esquelético.
Utrophin Upregulation
Regulação utrophin é de grande interesse, uma vez que serve como o parálogo endógena mais próximo dentro do genoma humano. Este gene é mais curto e localizado no cromossoma 6 em humanos. Os pesquisadores estão atualmente com foco na compreensão do regulamento atrás de sua expressão dentro das células. Verificou-se anteriormente (note Kay Davies) que sobre-regulação de utrofina pode compensar parcialmente as células do músculo sem expressão da distrofina.
Cuidados de suporte - Desenvolvimento de Medicamentos
Mostras recentes de investigação Losartan, uma droga actualmente disponíveis utilizados para o tratamento de hipertensão, para ser eficaz em parar o progresso da doença em murganhos que foram geneticamente modificados para ter Duchenne. Testes em humanos estão em planejamento.
Alguns pais de crianças com Duchenne são de notar reduções de gravidade sintomática de um regime de Protandim, um suplemento nutricional sem receita médica que aumenta os níveis de duas enzimas antioxidantes específicos. Outros pais relatam nenhum benefício. Ensaios clínicos controlados não têm sido realizados, e observações pai pode ter sido influenciado por fatores de confusão como viés de expectativa, o progresso do desenvolvimento normal, ea prática comum de implementar suplementos nutricionais adicionais e / ou corticosteróides concomitantes com a Protandim. No entanto, é promissor Protandim a um nível teórico, na medida em que tem o potencial para modificar o ciclo inflamatório morte / célula. Ensaios DMD mouse-modelo da terapia estão em andamento, e os testes em humanos são planejadas.
Investigação de um grupo na França liderada por L. Segalat identificou uma série de medicamentos que são atualmente licenciados para outras aplicações como travar ou reduzir drasticamente o avanço da degeneração muscular em um modelo de verme da DMD. Eles agora estão usando modelos do rato para confirmar esses resultados, que até agora estão olhando muito promissor, confirmando a eficácia dessas drogas. No entanto, o trabalho em camundongos parece estar se movendo lentamente. As principais classes de drogas que foram identificados SSRI (ou seja, anti-depressivos, tais como Prozac) e relaxantes musculares, tais como aqueles usados por atletas após treinamento pesado. Há evidências conflitantes a partir de modelos animais que sugerem que fazendo menos exercício diminui a taxa de degeneração do músculo; Por conseguinte, existe uma possibilidade de que ambas estas drogas actuam um pouco como sedativos, embora a realidade parece ser que os vermes e ratos são mais activos em geral, uma vez que têm menos lesões musculares e assim pode permanecer activa durante muito mais tempo.
Mais recentemente, um grupo no Instituto do Coração de Montreal e da Universidade McGill relataram que um mouse modelo de distrofia muscular de Duchenne demonstrou alterações metabólicas precoces que antecedem ostensivas cardiomiopatia e pode representar uma "subclínica" assinatura inicial de um defeito óxido nítrico (NO) / GMPc. Por conseguinte, eles usaram abordagens genéticas e farmacológicas para testar a hipótese de que o aumento de GMPc, a jusante de formação de NO, melhora a função contráctil, metabolismo energético, e integridade do sarcolema. O tratamento com O sildenafil atrasou o aparecimento de sintomas em corações de rato com Duchenne e deixada a resistir a um aumento da carga de trabalho cardíaco agudo.
Ensaios Clínicos
Mais informações sobre o novo Ensaios PTC124, atualmente se aproximam do final da Fase II, está disponível no site da MDA.org. Este tratamento potencial trataria de 5 a 15 por cento dos casos de DMD onde a proteína distrofina não pode ser concluída, devido a uma incorrecta codão de terminação na sequência genética. O tratamento PTC124 ignora o imprópria "stop" instrução, permitindo a leitura através da sequência restante e conclusão do processo de montagem da proteína distrofina. Em estudos recentes do rato, PTC124 foi encontrada para reparar tecidos musculares danificados. Ensaios clínicos para exão pular com Morfolino e com oligos Os oligos de 2'-O-metilo fosforotioato estão em progresso.
Prevenção
O aconselhamento genético é recomendado para pessoas com história familiar da doença. Distrofia muscular de Duchenne pode ser detectada com precisão cerca de 95%, em estudos genéticos realizados durante a gravidez.
Organizações específicas para DMD
Além de instituições de caridade dedicados a distrofias musculares em geral (como MDA), essas instituições de caridade são dedicados exclusivamente a DMD:
- Pais United Projeto distrofia muscular: Pais United Projetos MD é uma organização internacional que foi criada pelos pais e amigos dos meninos com DMD.
- Pai Projeto distrofia muscular: missão Pais Projeto Distrofia Muscular é de melhorar o tratamento, qualidade de vida e as perspectivas de longo prazo para todos os indivíduos afetados pela distrofia muscular de Duchenne (DMD) através da investigação, defesa, educação e compaixão.
- Fundo de Charley: uma organização cuja missão é financiar a pesquisa para a cura ou tratamento para Duchenne. Fundo de Charley investe dinheiro na investigação de translação - investigação que incide sobre movendo ciência do laboratório para testes clínicos em humanos.
- Darius vai West Foundation: uma fundação que giram em torno do filme documentário intitulado Darius Goes West (DGW). DGW ganhou mais de 25 prêmios do festival de cinema em 2007, tornando-se o filme mais homenageado no circuito naquele ano. Ele apresenta a história de Darius Weems, um calouro de quinze anos de idade, com DMD, que sai de casa com seus onze melhores amigos em uma tentativa de ver sua cadeira de rodas personalizadas em Pimp my ride da MTV. Assista Trailer. Cada DVD vendidos levanta US $ 17 para a investigação DMD.
- JettFund: Atualmente, 25 adolescentes estão ciclismo em toda a América para levantar fundos para os adolescentes com DMD.
- CureDuchenne: é uma organização sem fins lucrativos que financia agressivamente pesquisa de ponta para tratamentos e uma cura para a distrofia muscular de Duchenne.
- Ação Duchenne: financia exclusivamente a pesquisa para uma cura e promove campanhas para uma melhor assistência médica para Duchenne e distrofia muscular de Becker.
- SONHO Foundation: uma organização baseada Louisville, KY dedicada a levantar fundos e consciência. Além disso, a fundação financiado (através de doação) a construção de cinco parques infantis na área de Louisville especificamente projetado para uso por crianças com DMD.
