Cinética enzimática
Informações de fundo
Crianças SOS, que corre cerca de 200 sos escolas no mundo em desenvolvimento, organizado esta selecção. patrocínio SOS Criança é legal!

Cinética enzimática é o estudo das reacções químicas que são catalisadas pelos enzimas, com foco em suas taxas de reação . O estudo de uma enzima de cinética revela o mecanismo catalítica desta enzima, o seu papel na metabolismo, como a sua actividade é controlada, e como um droga ou um veneno poder inibir a enzima.
As enzimas são normalmente proteínas moléculas que manipulam outras moléculas - as enzimas ' substratos. Estas moléculas alvo ligam-se a uma enzima de local activo e são transformados em produtos através de uma série de passos conhecido como o mecanismo enzimático. Estes mecanismos podem ser divididos em mecanismos de substrato único e de múltiplos substratos. Os estudos cinéticos sobre enzimas que só se ligam um substrato, tais como triosefosfatoisomerase, visam medir o afinidade com que a enzima se liga este substrato e a taxa de rotatividade.
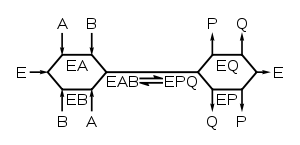
Quando as enzimas ligam vários substratos, tais como di-hidrofolato redutase (mostrado à direita), cinética da enzima pode também mostram a sequência em que estas se ligam substratos e a sequência em que os produtos são libertados. Um exemplo de enzimas que se ligam a um único substrato e libertam produtos múltiplos são proteases, que clivam um substrato proteico em dois produtos polipeptídicos. Outros se juntam dois substratos em conjunto, tais como ADN-polimerase que liga um nucleotido para ADN . Embora estes mecanismos são frequentemente uma série complexa de passos, existe tipicamente um passo determinante da velocidade que determina a cinética total. Este passo pode ser uma reacção química determinante da taxa ou um alteração conformacional da enzima ou substratos, tais como aqueles que estão envolvidos na libertação de produto (s) a partir da enzima.
O conhecimento da A estrutura da enzima é útil na interpretação dos dados cinéticos. Por exemplo, a estrutura pode sugerir como substratos e produtos se ligam durante a catálise; quais as mudanças ocorrem durante a reacção; e ainda o papel de determinados aminoácidos resíduos no mecanismo. Algumas enzimas mudam de forma significativa durante o mecanismo; em tais casos, é útil para determinar a estrutura da enzima com e sem análogos de substratos ligados que não se submetem a reacção enzimática.
Nem todos os catalisadores biológicos são proteínas enzimas; Catalisadores à base de ARN, tais como e ribozimas ribossomas são essenciais para muitas funções celulares, tais como RNA splicing e tradução. A principal diferença entre as ribozimas e enzimas é que os catalisadores de ARN realizar um conjunto mais limitado de reacções, embora a sua mecanismos de reação e cinética podem ser analisados e classificados pelos mesmos métodos.
Princípios gerais
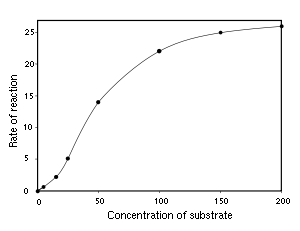
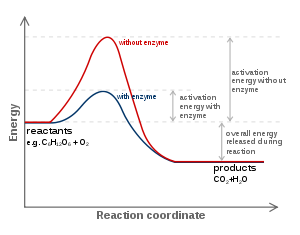
A reacção catalisada por uma enzima utiliza exactamente os mesmos reagentes e produz exactamente os mesmos produtos que a reacção não catalisada. Como outros catalisadores , as enzimas não alteram a posição do equilíbrio entre os substratos e produtos. No entanto, ao contrário de reacções químicas não catalisada, as reacções catalisadas por enzimas exibem cinéticas de saturação. Para uma dada concentração de enzima e para concentrações relativamente baixas de substrato, a velocidade da reacção aumenta linearmente com a concentração de substrato; as moléculas de enzima são em grande parte livre para catalisar a reacção, e o aumento da concentração de substrato significa um aumento da taxa à qual as moléculas de enzima e de substrato encontram um ao outro. No entanto, a concentrações relativamente elevadas de substrato, a velocidade de reacção assintoticamente se aproxima do máximo teórico; os locais de enzimas activas são quase todos ocupados e a velocidade da reacção é determinada pela taxa de turnover intrínseca da enzima. O meio do caminho concentração de substrato entre estes dois casos limites é denotada por K M.
As duas propriedades cinéticas mais importantes de uma enzima é a rapidez com que a enzima torna-se saturado com um substrato particular, e a taxa máxima pode atingir. Sabendo estas propriedades sugere que uma enzima pode fazer no celular e pode mostrar como a enzima irá responder a mudanças nessas condições.
Os ensaios enzimáticos
Os ensaios enzimáticos são procedimentos laboratoriais que medem a taxa de reacções enzimáticas. Porque as enzimas não são consumidas pelas reacções que catalisam, ensaios enzimáticos normalmente seguir alterações na concentração de ambos os substratos ou produtos para medir a velocidade da reacção. Existem diversos métodos de medição. Ensaios espectrofotométricos observar mudança no absorvância de luz entre os produtos e reagentes; ensaios radiométricos envolvem a incorporação ou libertação de radioactividade para medir a quantidade de produto feito ao longo do tempo. Ensaios espectrofotométricos são mais convenientes, uma vez que permitem que a velocidade da reacção a ser medida continuamente. Embora ensaios radiométricos exigem a remoção e a contagem das amostras (isto é, eles são ensaios descontínuos) são normalmente muito sensíveis e podem medir níveis muito baixos de actividade da enzima. Uma abordagem semelhante é a utilização de espectrometria de massa para monitorizar a incorporação ou a libertação de isótopos estáveis como substrato é convertido em produto.
Os ensaios enzimáticos mais sensíveis usam lasers focados através de um microscópio para observar mudanças em moléculas de enzima individuais, que catalisam as reações. Estas medidas, quer mudanças no uso do de fluorescência cofactores durante mecanismo de reacção de uma enzima, ou de corantes fluorescentes adicionados em sítios específicos da proteína para comunicar movimentos que ocorrem durante a catálise. Estes estudos estão oferecendo uma nova visão da cinética e dinâmica de enzimas individuais, em oposição a cinética enzimática tradicionais, que observa o comportamento médio das populações de milhões de moléculas de enzima.
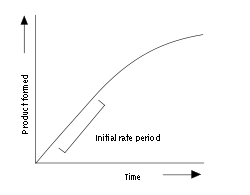
À esquerda é mostrada uma curva de progresso típico para um ensaio enzimático. A enzima produz um produto no linear taxa inicial no início da reacção. Mais tarde nesta curva de progresso, a taxa diminui como substrato é usado para cima ou produtos se acumulam. A duração do período inicial de taxa depende das condições do ensaio e pode variar desde milissegundos até horas. Os ensaios enzimáticos geralmente são criados para produzir uma taxa inicial que durou mais de um minuto, para fazer medições mais fácil. No entanto, equipamentos para líquidos rapidamente de mistura permite medições cinéticas rápidas sobre as taxas iniciais de menos de um segundo. Estes ensaios são muito rápidas essenciais para medir a cinética de pré-estado-estacionário, que são discutidas abaixo.
A maior parte dos estudos cinéticos enzimáticos concentram nesta parte inicial, linear de reacções enzimáticas. No entanto, também é possível medir a curva de se completar a reacção e ajustar os dados para um não-linear equação da taxa. Esta forma de medir reações enzimáticas é chamado de análise do progresso da curva. Esta abordagem é útil como uma alternativa a rápida cinética quando a taxa inicial é demasiado rápido para medir com precisão.
Um único substrato reacções-
Enzimas com mecanismos único substrato incluem- isomerases tais como triosephosphateisomerase ou bisfosfoglicerato mutase, intramolecular liases tal como adenilato-ciclase ea ribozima, um lyase RNA. No entanto, algumas enzimas que possuem apenas um único substrato não se enquadram nesta categoria de mecanismos. A catalase é um exemplo deste, como a enzima reage com uma primeira molécula de peróxido de hidrogénio do substrato, torna-se oxidado e é então reduzido por uma segunda molécula de substrato. Embora um único substrato é envolvido, a existência de uma enzima modificada meios intermédios que o mecanismo de catalase é, na verdade, um mecanismo de ping-pong, um tipo de mecanismo que é discutido na secção a reacções de multi-substrato abaixo.
Cinética de Michaelis-Menten
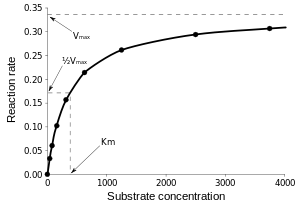
Como as reacções catalisadas por enzimas são saturável, a sua taxa de catálise não mostram uma resposta linear ao aumento de substrato. Se a taxa inicial da reacção é medida ao longo de uma gama de concentrações de substrato (denotado como [S]), a velocidade da reacção (v) aumenta à medida que [S] aumenta, como se mostra à direita. No entanto, como [S] fica maior, a enzima torna-se saturado com o substrato e a taxa atinge Vmax, taxa máxima da enzima.
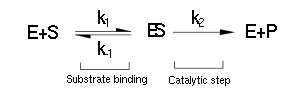
O Michaelis-Menten modelo de cinética de uma reacção de um único substrato é mostrado à direita. Há uma inicial reacção bimolecular entre a enzima e substrato S E para formar as ES complexo enzima-substrato. Embora o mecanismo enzimático para a reação unimolecular 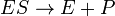 reacção pode ser bastante complexo, existe tipicamente um passo determinante da velocidade enzimática que permite que o mecanismo a ser modelado como um único passo catalítico de taxa constante k 2.
reacção pode ser bastante complexo, existe tipicamente um passo determinante da velocidade enzimática que permite que o mecanismo a ser modelado como um único passo catalítico de taxa constante k 2.
![\ Begin {matrix} v = k_2 [\ mbox {ES}] \ end {matrix}](../../images/557/55719.png) (Equação 1).
(Equação 1).
k 2 é também chamado de k cat ou o número de turnover, o número máximo de reacções enzimáticas catalisadas por segundo.
A baixas concentrações de substrato [S], a enzima existe num equilíbrio entre ambas as formas livre e E ES complexos enzima-substrato; aumentando a [S] reforça igualmente a [ES] em detrimento de [E], deslocando o equilíbrio de ligação para a direita. Uma vez que a velocidade da reacção depende da concentração de [ES], a taxa é sensível a pequenas alterações na [S]. No entanto, a muito alta [S], a enzima é completamente saturada com substrato, e só existe sob a forma ES. Sob estas condições, a taxa (V ≈ k 2 [E] tot = Vmax) é insensível a pequenas alterações em [s]; aqui, [E] tot é a concentração total de enzima
que é aproximadamente igual à concentração de [ES] em condições de saturação.
O Equação de Michaelis-Menten descreve como a velocidade da reacção v depende da posição do substrato de ligação de equilíbrio e a taxa constante k 2. Michaelis e Menten mostrou quando k 2 é muito menor do que k -1 (chamado o pressuposto de equilíbrio) que pode derivar a equação seguinte:
![v = \ frac {V_ \ max [\ mbox {s}]} {K_m + [\ mbox {s}]}](../../images/557/55721.png) (Equação 2)
(Equação 2)
Esta equação de Michaelis-Menten, é a base para a maioria cinética enzimática de um único substrato.
A constante de Michaelis Km é definida como a concentração para a qual a taxa da reacção da enzima é metade V máx. Isto pode ser verificado pela substituição de [S] = K m para a equação de Michaelis-Menten. Se o passo determinante da velocidade enzimática é lento em comparação com o substrato de dissociação (K 2 << k-1), a constante de Michaelis Km é aproximadamente o constante de dissociação do complexo ES, embora esta situação é relativamente raro.
A situação mais normal onde k 2> k -1 é às vezes chamado Briggs Cinética de Haldane. A equação de Michaelis-Menten ainda se mantém sob estas condições mais gerais, tal como pode ser derivada a partir da aproximação de estado estacionário. Durante o período de velocidade inicial, a velocidade da reacção v é mais ou menos constante, indicando que [ES] é semelhante constante (cf. equação 1):
Portanto, a concentração de [ES] é dada pela fórmula
onde a constante de Michaelis Km é definida
([E] é a concentração da enzima livre). Tomados em conjunto, a fórmula geral para a velocidade da reacção v é novamente a equação de Michaelis-Menten:
A constante de especificidade 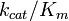 é uma medida de quão eficazmente uma enzima converte um substrato em produto. Utilizando a definição da constante de Michaelis
é uma medida de quão eficazmente uma enzima converte um substrato em produto. Utilizando a definição da constante de Michaelis 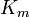 , A equação de Michaelis-Menten pode ser escrito sob a forma
, A equação de Michaelis-Menten pode ser escrito sob a forma
onde [E] o é a concentração de enzima livre. Assim, a constante de especificidade é um eficaz taxa de segunda ordem constante para enzima livre para reagir com o substrato livre para formar produto. A constante de especificidade é limitada pela frequência com que o substrato e enzima encontro uns aos outros em solução, tão elevada como 10 10 M-1 s -1. Notavelmente, esta taxa máxima não é afectada pelo tamanho, quer do substrato ou do enzima. O rácio das constantes de especificidade para dois substratos é uma comparação quantitativa de quão eficiente é a enzima na conversão desses substratos. A inclinação do gráfico de Michaelis-Menten em baixa concentração de substrato [S] (em que [S] << K m) também produz a constante de especificidade.
Parcelas lineares da equação de Michaelis-Menten
Usando um interativo cinética de Michaelis-Menten tutorial na Universidade da Virgínia, os efeitos sobre o comportamento de uma enzima variando de constantes cinéticas pode ser explorado.
A trama de V versus [S] acima não é linear; embora inicialmente linear em baixo [S], ele se inclina sobre a saturar a alta [S]. Antes da era moderna de curva de ajuste não-linear em computadores, esta não linearidade poderia torná-lo difícil de estimar K m e V max com precisão. Portanto, vários investigadores desenvolveram linearização da equação de Michaelis-Menten, como o Lineweaver-Burk enredo, a Diagrama de Eadie-Hofstee eo Hanes-Woolf enredo. Todas estas representações lineares pode ser útil para a visualização de dados, mas nenhum deve ser usado para determinar os parâmetros cinéticos, como software de computador está prontamente disponível que permite uma determinação mais precisa por métodos de regressão não-linear.
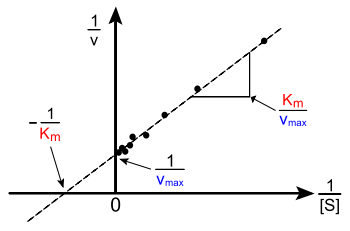
O Lineweaver-Burk parcela ou parcela dupla recíproca é forma comum de ilustrar os dados cinéticos. Esta é produzida por tomar o recíproca de ambos os lados da equação de Michaelis-Menten. Como mostrado no lado direito, esta é uma forma linear de equação de Michaelis-Menten e produz uma linha recta com a equação y = mx + c com um equivalente -intercept y 1 / V max e uma -intercept x do gráfico representando -1 / K m.
Naturalmente, não há valores experimentais podem ser tomadas a negativo 1 / [S]; o valor limite inferior de 1 / [S] = 0 (o y -intercept) corresponde a uma concentração de substrato de infinito, em que 1 / v = 1 / Vmax, como mostrado à direita; Assim, o x é um -intercept extrapolação dos dados experimentais obtidos em concentrações positivos. De modo mais geral, o enredo Lineweaver-Burk distorce a importância das medidas tomadas em baixas concentrações de substrato e, portanto, pode produzir estimativas imprecisas de V max e K m. Um método traçado linear mais preciso é o Eadie-Hofstee enredo. Neste caso, v é registada em função do v / [S]. Na terceira representação linear comum, o Hanes-Woolf enredo, [S] / v é plotado contra [S]. Em geral, a normalização de dados pode ajudar a diminuir a quantidade de trabalho experimental e pode aumentar a fiabilidade dos resultados, e é adequado tanto para análise gráfica e numérica.
O significado prático da constantes cinéticas
O estudo da cinética da enzima é importante por duas razões básicas. Em primeiro lugar, ajuda a explicar como as enzimas trabalham, e em segundo lugar, ele ajuda a prever como se comportam enzimas em organismos vivos. As constantes cinéticas acima definidas, K m e V max, são fundamentais para tentativas de compreender como as enzimas trabalham em conjunto para controlar metabolismo.
Fazer estas previsões não é trivial, mesmo para sistemas simples. Por exemplo, oxaloacetato é formado pelos malato-desidrogenase na mitocôndria . Oxaloacetato pode então ser consumido por citrato sintase, carboxicinase fosfoenolpiruvato ou aspartato aminotransferase, a alimentação no ciclo do ácido cítrico, gluconeogenesis ou biossíntese do ácido aspártico, respectivamente. Ser capaz de prever a quantidade de oxaloacetato, que entra na via requer o conhecimento da concentração de oxaloacetato, bem como a concentração e cinética de cada uma destas enzimas. Este objectivo de prever o comportamento das vias metabólicas atinge a sua expressão mais complexa na síntese de grandes quantidades de cinética e dados de expressão gênica em modelos matemáticos de organismos inteiros. Embora este objectivo está longe no futuro para qualquer eucariota , as tentativas estão sendo feitos para alcançar isto em bactérias , com modelos do metabolismo Escherichia coli agora sendo produzidos e testados.
Reacções de multi-substrato
Reações multi-substrato seguem complexas equações de taxa que descrevem como ligar os substratos e em que seqüência. A análise destas reacções é muito mais simples se a concentração de substrato é um substrato mantida constante e B variada. Sob essas condições, a enzima se comporta exatamente como um único substrato enzimático e um terreno de v por [S] dá aparente K m e V max constantes para substrato B. Se um conjunto dessas medidas é realizada em diferentes concentrações fixas de A, estes dados podem ser utilizados para elaborar o que o mecanismo da reacção é. Para uma enzima que leva dois substratos A e B e os transforma em dois produtos P e Q, existem dois tipos de mecanismo: complexo ternário e ping-pong.
Mecanismos complexos ternário-
Nestes enzimas, ambos os substratos se ligam à enzima, ao mesmo tempo para produzir um complexo ternário EAB. A ordem de ligação pode ser aleatória (em um mecanismo aleatório) ou substratos têm de se ligar de uma sequência particular (em um mecanismo ordenada). Quando um conjunto de v por curvas [S] (fixas A, B) variando de uma enzima com um mecanismo complexo ternário-são plotados em um Lineweaver-Burk enredo, o conjunto de linhas produzidos cruzará.
Enzimas com mecanismos complexos ternário incluem- glutationa S -transferase, e di-hidrofolato redutase DNA polimerase. Os links a seguir mostra as animações curtas dos mecanismos ternários-complexo da enzimas dihidrofolato redutase e DNA polimerase.
Mecanismos de ping-pong
Como mostrado no lado direito, enzimas com um mecanismo de ping-pong pode existir em dois estados, E e uma forma quimicamente modificada da enzima E *; esta enzima modificada é conhecida como um intermediária. Nestes mecanismos, liga-se um substrato, a enzima altera a E * por, por exemplo, a transferência de um grupo químico ao local activo, e é depois libertada. Somente depois que o primeiro substrato é liberada pode substrato B ligam e reagem com a enzima modificada, regenerando o formulário E não modificado. Quando um conjunto de v por [S] curvas (A fixo, variando B) a partir de uma enzima com um mecanismo de ping-pong são plotados em um gráfico de Lineweaver-Burk, um conjunto de linhas paralelas serão produzidos.
Enzimas com mecanismos de ping-pong incluem alguns oxidorredutases, tais como peroxidase thioredoxin, transferases, tais como acylneuraminate e cytydilyltransferase as proteases de serina, tais como e tripsina quimotripsina. Serinaproteases são uma família muito comum e diverso de enzimas, incluindo enzimas digestivas (tripsina, quimiotripsina, elastase), e várias enzimas da cascata de coagulação do sangue e muitos outros. Nestes proteases de serina, o intermediário E * é uma espécie acil-enzima formadas pelo ataque de um local activo um resíduo de serina na ligação peptídica num substrato proteico. Uma pequena animação que mostra o mecanismo de quimiotripsina está ligada aqui.
Cinética não Michaelis-Menten
Algumas enzimas produzem um sigmóide v por parcela [S], que muitas vezes indica ligação cooperativa do substrato ao local activo. Isto significa que a ligação de uma molécula de substrato afecta a ligação de moléculas de substrato subsequentes. Este comportamento é mais comum no enzimas multiméricas com vários sites ativos que interagem. Aqui, o mecanismo de cooperação é semelhante ao do hemoglobina, com a ligação de um substrato ao local activo, que altera a afinidade dos outros locais activos de moléculas de substrato. Cooperatividade positiva ocorre quando a ligação da primeira molécula de substrato aumenta a afinidade dos outros locais activos para substrato. Cooperatividade negativa quando ocorre ligação do primeiro substrato diminui a afinidade da enzima para outras moléculas de substrato.
Alostéricas enzimas de mamífero incluem tirosil-ARNt-sintetase, que mostra cooperatividade negativa, e bacteriana aspartato transcarbamilase e fosfofrutoquinase, que mostram cooperatividade positiva.
Cooperatividade é surpreendentemente comum e pode ajudar a regular as respostas das enzimas para alterações nas concentrações dos seus substratos. Cooperatividade positiva faz enzimas muito mais sensível a [S] e as suas actividades podem mostrar grandes mudanças ao longo de uma estreita faixa de concentração de substrato. Por outro lado, cooperatividade negativa faz enzimas insensíveis a pequenas mudanças na [S].
O Equação de Hill é muitas vezes usado para descrever o grau de cooperatividade quantitativamente na cinética não de Michaelis-Menten. The Hill coeficiente n medidas derivadas quanto a ligação de substrato para um sítio ativo afeta a ligação de substrato para os outros sites ativos. Um coeficiente de Hill <1 indica cooperatividade negativa e um coeficiente de> 1 indica positiva cooperatividade.
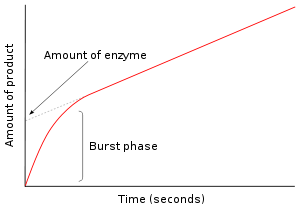
Cinética de estado pré-estacionário
No primeiro momento, depois de uma enzima é misturada com o substrato, nenhum produto foi formado e nenhuma existem intermediários. O estudo dos próximos milissegundos da reacção é chamada cinética de estado pré-estável. Cinética de estado de pré-equilíbrio é, portanto, diz respeito à formação e consumo de intermediários enzima-substrato (tal como ES ou E *) até ao seu concentrações de estado estacionário são atingidos.
Esta abordagem foi aplicada em primeiro lugar a reacção de hidrólise catalisada pela quimotripsina. Muitas vezes, a detecção de um intermediário é uma parte vital de provas em investigações de que mecanismo uma enzima segue. Por exemplo, nos mecanismos de ping-pong que são mostrados de cima, medições cinéticas rápidas pode seguir a libertação de produto P e medir a formação do intermediário enzima modificada E *. No caso da quimotripsina, este intermediário é formado pelo ataque do substrato pela serina nucleofílico no local activo e a formação do intermediário acil-enzima.
Na figura à direita, a enzima produz E * rapidamente nos primeiros segundos de reacção. A taxa, em seguida, diminui conforme o estado estacionário é atingido. Esta fase do sincronismo rápida da reacção mede uma única rotação da enzima. Por conseguinte, a quantidade de produto libertado neste explosão, como a intercepção no -axis y do gráfico, também dá a quantidade de enzima funcional que está presente no ensaio.
Mecanismo químico
Um objectivo importante da medição de cinética enzimática é determinar o mecanismo químico de uma reacção enzima ti ca, isto é, a sequência de passos químicos que transformam substrato em produto. As abordagens cinéticas discutidas acima irá mostrar em que as taxas de intermediários são formados e inter-convertidos, mas não pode identificar exactamente o que estes são intermediários.
As medidas cinéticas feita sob várias condições de solução ou em enzimas ou substratos ligeiramente modificada frequentemente esclarecer este mecanismo químico, em que revelam o passo determinante da taxa ou intermediários na reacção. Por exemplo, a quebra de um ligação covalente de um átomo de hidrogénio átomo é um passo determinante da velocidade comum. Qual das possíveis transferências de hidrogênio é a taxa de determinação pode ser mostrado através da medição dos efeitos cinéticos de substituindo cada um hidrogénio por deutério, seu estábulo isótopo . A taxa mudará quando o hidrogénio é substituído crítica, devido a um primário efeito isotópico cinético, que ocorre porque as ligações para o deutério são mais difíceis de quebrar, em seguida, títulos de hidrogênio. Também é possível medir os efeitos semelhantes com outras substituições isotópicas, tais como 13 C / 12 C e 18 O / 16 O, mas estes efeitos são mais subtis.
Isótopos também pode ser utilizada para revelar o destino de várias partes das moléculas de substrato em produtos finais. Por exemplo, é por vezes difícil discernir a origem de um oxigénio átomo no produto final; uma vez que pode ter vindo de água ou de uma parte do substrato. Isto pode ser determinado através da substituição sistemática isótopo estável de oxigénio de 18 O para as várias moléculas que participam na reacção e controlo para o isótopo no produto. O mecanismo químico também pode ser elucidado através do exame dos efeitos cinéticos e de isótopos sob diferentes condições de pH, através da alteração dos iões de metal ou outro limite cofactores, por mutagénese de resíduos de aminoácidos conservados, ou estudando o comportamento da enzima na presença de análogos do substrato (s) dirigida ao local.
A inibição de enzimas
Os inibidores de enzimas são moléculas que reduzem ou anulam a actividade da enzima. Estes são ou reversível (ou seja, a remoção do inibidor restaura a actividade da enzima) ou irreversível (ou seja, o inibidor da enzima inactiva permanentemente).
Inibidores reversíveis
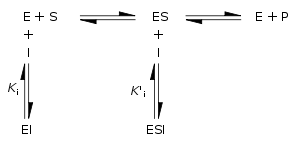
Inibidores da enzima reversíveis podem ser classificados como competitivo, não competitivo, não competitivo ou mista, de acordo com os seus efeitos sobre K m e V max. Estes diferentes efeitos resultam da ligação à enzima E inibidor, para o ES complexo enzima-substrato, ou a ambos, como se mostra na figura, para a direita e a tabela abaixo. O tipo particular de um inibidor pode ser discernido pela estuda a cinética da enzima como uma função da concentração de inibidor. Os quatro tipos de inibição produtos Lineweaver-Burke e Eadie-Hofstee parcelas que variam de formas distintas com concentração de inibidor. Para abreviar, dois símbolos são usados:
![\ Alpha = 1 + \ frac {[\ mbox {I}]} {K_ {i}}](../../images/557/55760.png) e
e ![\ Alpha ^ {\ prime} = 1 + \ frac {[\ mbox {I}]} {K_ {i} ^ {\ prime}}](../../images/557/55761.png)
onde K i e K 'i são o As constantes de dissociação para a ligação à enzima e o complexo enzima-substrato, respectivamente. Na presença do inibidor reversível, aparente K m e V max da enzima tornam-se (α / α ') K m e (1 / α') V max, respectivamente, como mostrado abaixo para os casos comuns.
| Tipo de inibição | K m aparente | Vmax aparente | ||
| K i only | ( 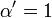 ) ) | competitivo | 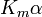 | 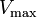 |
| K i only ' | ( 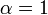 ) ) | uncompetitive |  | 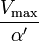 |
| K i = K i ' | ( 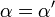 ) ) | não competitivo | 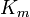 | 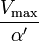 |
| K i ≠ K i ' | ( 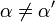 ) ) | misto | 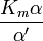 | 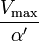 |
Ajustes de regressões não-lineares dos dados cinéticos da enzima às equações de velocidade acima pode produzir estimativas precisas do constantes de dissociação K i e K 'i.
Os inibidores irreversíveis
Os inibidores de enzimas também podem inactivar de forma irreversível enzimas, geralmente por covalentemente modificação de resíduos de locais activos. Estas reações, que podem ser chamados de substratos suicidas, siga funções e decaimento exponencial são geralmente saturable. Abaixo da saturação, eles seguem de primeira ordem em relação à cinética de inibidor.
Os mecanismos de catálise
O modelo preferido para a interacção enzima-substrato é o modelo de ajuste induzido. Este modelo propõe que a interacção inicial entre a enzima e o substrato é relativamente fraco, mas que estas interacções fracas rapidamente induzir mudanças conformacionais na enzima que fortalecem ligação. Estes alterações conformacionais também trazer resíduos catalíticos no local activo perto das ligações químicas no substrato que vai ser alterados na reacção. Após a ligação tem lugar, um ou mais mecanismos de catálise diminuem a energia da reacção de de transição de estado, fornecendo uma via alternativa para a química da reacção. Mecanismos de catálise incluem a catálise por ligação estirpe; por proximidade e orientação; por ativo local doadores de prótons ou receptores; covalente catálise e tunelamento quântico.
Cinética enzimática não pode provar que os modos de catálise são usados por uma enzima. No entanto, alguns dados cinéticos podem sugerir possibilidades de ser examinado por outras técnicas. Por exemplo, um mecanismo de ping-pong com uma cinética de fase do sincronismo no estado de pré-estável sugeriria catálise covalente pode ser importante no mecanismo deste enzima. Alternativamente, a observação de um efeito forte sobre o pH, mas não Vmax K m pode indicar que um resíduo do local activo necessita estar em uma determinada estado de ionização para a catálise ocorra.
![[\ Mbox {E}] _ \ mathrm {tot} \ \ stackrel {\ mathrm {def}} {} = \ [\ mbox {E}] + [\ mbox {ES}]](../../images/557/55720.png)
![\ Frac {d} {dt} [\ mbox {ES}] = k_ {1} [\ mbox {E}] [\ mbox {s}] - k_ {2} [\ mbox {ES}] - k _ {- 1} [\ mbox {ES}] \ aproximadamente 0.](../../images/557/55722.png)
![[\ Mbox {ES}] \ approx \ frac {[\ mbox {E}] _ \ mathrm {tot} [\ mbox {s}]} {[\ mbox {} S] + K_ {m}}](../../images/557/55723.png)
![K_ {m} \ \ stackrel {\ mathrm {def}} {=} \ \ frac {k_ {2} + k _ {- 1}} {k_ {1}} \ approx \ frac {[\ mbox {E}] [\ mbox {s}]} {[\ mbox {ES}]}](../../images/557/55724.png)
![v = k_ {2} [\ mathrm {ES}] = \ frac {k_ {2} [\ mbox {E}] _ \ mathrm {tot} [\ mbox {s}]} {[\ mbox {} S] + K_ {m}} = \ frac {V_ \ max [\ mbox {s}]} {[\ mbox {} S] + K_ {m}}.](../../images/557/55725.png)
![v = k_ {2} [\ mathrm {ES}] = \ frac {k_ {2}} {{K_ m}} [\ mbox {E}] [\ mbox {} S]](../../images/557/55728.png)
![\ Frac {1} {v} = \ frac {K_ {m}} {V_ \ max [\ mbox {s}]} + \ frac {1} {V_ \ max}](../../images/557/55736.png)