
Ácido fosfórico
Você sabia ...
Crianças SOS, que corre cerca de 200 sos escolas no mundo em desenvolvimento, organizado esta selecção. Você quer saber sobre o patrocínio? Veja www.sponsorachild.org.uk
| Ácido fosfórico | |
|---|---|
 | |
 | |
Outros nomes Ácido ortofosfato | |
| Identificadores | |
| Número CAS | 7664-38-2 |
| Propriedades | |
| Fórmula molecular | H 3 PO 4 |
| Massa molar | 98,0 g / mol |
| Aparência | ou sólido branco líquido incolor, viscoso (> 42 ° C) |
| Densidade | 1,685 g / ml (líquidos) |
| Ponto de fusão | 42,35 ° C, 316 K, 108 ° F |
| Ponto de ebulição | 158 ° C, 431 K, 316 ° C (decomp.) |
| Acidez (p Ka) | 2,12, 7,21, 12,67 |
| Viscosidade | 85% solução aquosa ? cP |
| Perigos | |
| Classificação da UE | Corrosivo (C) |
| Frases R | R34 |
| Frases-S | (S1 / 2), S26, S45 |
| Os compostos relacionados | |
| Outros aniões | Ácido nítrico Ácido arsénico |
| Outros cátions | Fosfato de amônio O fosfato trissódico |
| Ácido fósforo relacionadas | Ácido hipofosforoso O ácido fosforoso Ácido pirofosfórico Ácido tripolifosfórico Ácido hipofosfórico Ácido Perphosphoric Ácido Permonophosphoric |
| Excepto quando indicado, os dados são dados para materiais no seu estado normal (a 25 ° C, 100 kPa) | |
| Referências de Infobox | |
Ácido fosfórico, também conhecido como ácido ortofosfórico ou ácido fosfórico (V), é um ácido mineral (inorgânico) tendo a fórmula química H 3 P O 4. Em contraste, ortofosfórico ácido moléculas podem combinar-se para formar, com uma variedade de compostos a que se refere a ácidos fosfóricos como de uma forma mais geral. O termo ácido fosfórico também pode referir-se a um ou química reagente constituído por ácidos fosfóricos, normalmente ácido ortofosfórico principalmente.
Química Ácido ortofosfato
Ácido fosfórico anidro puro é um sólido branco que funde a 42,35 ° C, para formar um líquido viscoso incolor.
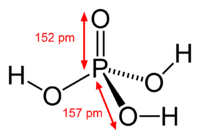
A maioria das pessoas e mesmo químicos referem-se ácido ortofosfórico, como o ácido fosfórico, que é o nome IUPAC para este composto. O orto prefixo é utilizado para distinguir o ácido de outros ácidos fosfóricos, chamados ácidos polifosfóricos. Ácido fosfórico é um não- , tóxico inorgânico , triprotic bastante fraca de ácido , o qual, quando pura, é um sólido na sala de temperatura e pressão. O estrutura química do ácido ortofosfórico é mostrado acima na tabela de dados. Ácido fosfórico é um muito polar molécula ; Por conseguinte, é altamente solúvel em água. O estado de oxidação de fósforo (P) nos ácidos fosfóricos orto- e outros é 5; o estado de oxidação de todas as oxigénio átomos de (S) é de -2 e todas as hidrogénio átomos (H) é uma. Triprotic significa que uma molécula de ácido ortofosfórico pode dissociar-se três vezes, dando-se um H + de cada vez, o que normalmente se mistura com uma molécula de água , H2O, como mostrado nestas reacções :
- H 3 PO 4 (s) + H2O (l) ⇌ H 3 O + (aq) + H 2 PO 4 - (aq) a1 K = 7,5 x 10 -3
- H 2 PO 4 - (aq) + H2O (l) ⇌ H 3 O + (aq) + HPO 4 2- (aq) A2 K = 6,2 x 10 -8
- HPO 4 2- (aq) + H2O (l) ⇌ H 3 O + (aq) + PO 4 3- (aq) a3 K = 2,14 x 10 -13
O anião após a primeira dissociação, H 2 PO 4 -, é o anião de di-hidrogenofosfato. O anião após a segunda dissociação, HPO 4 2-, é o anião fosfato de hidrogénio. O anião após a terceira dissociação, PO 4 3-, é a anião fosfato ou ortofosfato. Para cada uma das reacções de dissociação mostradas acima, existe uma separada ácido constante de dissociação, K chamado A1, A2 K, e K a3, dado a 25 ° C. Associado a estas três constantes de dissociação são correspondentes p K a1 = 2,12, p = 7,21 K a2, a3 e p K = 12,67 valores a 25 ° C. Embora todos os três de hidrogénio (H) átomos são equivalentes em uma molécula de ácido ortofosfórico, os sucessivos valores de K diferem uma vez que é energeticamente menos favorável para perder do outro, H +, se uma (ou mais) já se perdeu e a molécula / ião é mais negativamente carregada.
Uma vez que a dissociação triprotic de ácido ortofosfórico, o facto de a sua bases conjugadas (os fosfatos mencionados acima) cobrem uma ampla gama de pH, e, porque o ácido fosfórico / fosfato de soluções são, em geral, não tóxico, misturas destes tipos de fosfatos são muitas vezes utilizados como Os agentes tamponantes ou fazer soluções tampão, onde o pH desejado depende das proporções dos fosfatos nas misturas. Do mesmo modo, o não-tóxico, anião sais de triprotic orgânica ácido cítrico são também muitas vezes utilizados para fazer tampões. Os fosfatos são encontradas de forma generalizada em biologia, especialmente nos compostos derivados fosforilados de açúcares , tais como ADN , ARN, e de adenosina trifosfato (ATP). Há um artigo específico sobre fosfato como um anião ou os seus sais.
Depois de se aquecer o ácido ortofosfórico, condensação das unidades de ácido fosfórico pode ser induzida por libertação da água formada a partir da condensação. Quando uma molécula de água foi removido por cada duas moléculas de ácido fosfórico, o resultado é ácido pirofosfórico (H 4 P 2 O 7). Quando uma média de uma molécula de água por unidade fosfórico foi expelido, a substância resultante é um sólido que tem uma fórmula empírica de vítreo HPO 3 e é chamado ácido metafosfórico. Ácido metafosfórico é uma versão isoladamente anidro de ácido orthophosphoic e às vezes é usado como uma água ou reagente de absorção de umidade. Mais desidratação é muito difícil, e só pode ser realizado por meio de um extremamente forte dessecante (e não só através do aquecimento). Produz anidrido fosfórico, que tem uma fórmula empírica de P 2 O 5, embora uma molécula de facto tem uma fórmula química de P 4 O 10. Anidrido fosfórico é um sólido, o qual é muito fortemente aborbing de humidade e é utilizado como um dessecante.
p H e composição de uma solução de ácido fosfórico
Para uma dada concentração de ácido total de [A] = [H 3 PO 4] + [H 2 PO 4 -] + [HPO 4 2-] + [PO 4 3-] ([A] representa o número total de moles de puro H 3 PO 4, que foram usadas para preparar 1 litro de solução), a composição de uma solução aquosa de ácido fosfórico pode ser calculada usando as equações de equilíbrio associados com as três reacções descritas acima, em conjunto com a [H +] [OH -] = 10 -14 relação ea equação neutralidade eléctrica. O sistema pode ser reduzida para um quinto equação grau de [H +], que pode ser resolvida numericamente, obtendo-se:
| [A] (mol / L) | p H | [H 3 PO 4] / [A] (%) | [H 2 PO 4 -] / [A] (%) | [HPO 4 2-] / [A] (%) | [PO 4 3-] / [A] (%) |
| 1 | 1.08 | 91,7 | 8.29 | 6,20 x 10 -6 | 1,60 x 10 -17 |
| 10 -1 | 1.62 | 76,1 | 23,9 | 6,20 x 10 -5 | 5,55 x 10 -16 |
| 10 -2 | 2.25 | 43,1 | 56,9 | 6,20 x 10 -4 | 2,33 x 10 -14 |
| 10 -3 | 3.05 | 10,6 | 89,3 | 6,20 x 10 -3 | 1,48 x 10 -12 |
| 10 -4 | 4.01 | 1.30 | 98,6 | 6,19 x 10 -2 | 1,34 x 10 -10 |
| 10 -5 | 5.00 | 0,133 | 99,3 | 0,612 | 1,30 x 10 -8 |
| 10 -6 | 5,97 | 1,34 x 10 -2 | 94,5 | 5.50 | 1,11 x 10 -6 |
| 10 -7 | 6,74 | 1,80 x 10 -3 | 74,5 | 25.5 | 3,02 x 10 -5 |
| 10 -10 | 7.00 | 8,24 x 10 -4 | 61,7 | 38,3 | 8,18 x 10 -5 |
Para grandes concentrações de ácido, a solução é composta principalmente de H 3 PO 4. Para [A] = 10 -2, o p H é fechada para p K a1, dando uma mistura equimolar de H 3 PO 4 e H 2 PO 4 -. Para [A] abaixo de 10 -3, a solução é composta principalmente de H 2 PO 4 - com [HPO 4 2-] tornar-se não desprezável para soluções muito diluídas. [PO 4 3-] é sempre negligenciável.
O ácido fosfórico como um reagente químico
75-85% puro aquosas soluções (o mais comum) são límpida, incolor, inodoro, não- voláteis, em vez viscosos, xaroposo líquidos , mas ainda pourable. O ácido fosfórico é muito comumente utilizado como um solução aquosa de 85% de ácido fosfórico ou H 3 PO 4. Por se tratar de um ácido concentrado, uma solução de 85% pode ser corrosivo, embora não tóxica quando diluído. Devido à elevada percentagem de ácido fosfórico neste reagente, pelo menos algum do ácido ortofosfórico é condensado em ácidos polifosfóricos em uma função da temperatura de equilíbrio , mas, por uma questão de simplicidade e de rotulagem, a 85% representa H 3 PO 4, tal como se fosse todo o ácido fosfórico. Outros percentagens são possíveis também, mesmo acima de 100%, em que os ácidos fosfóricos e água seria num equilíbrio não especificado, mas o elemental global o conteúdo molar seria considerado especificado. Quando soluções aquosas de ácido fosfórico e / ou fosfato são diluído, eles estão em ou irá alcançar um equilíbrio depois de um tempo em que as unidades de fosfato de praticamente todo o fosfóricos / estão na forma orto-.
Preparação de halogenetos de hidrogénio
O ácido fosfórico reage com halogenetos para formar o correspondente halogeneto de hidrogénio gás (vapores húmidos são observados no aquecimento da mistura de reacção). Este é um procedimento comum para a preparação laboratorial de haletos de hidrogénio.
- 3NaCl (s) + H 3 PO 4 (l) → NaH 2 PO 4 (s) + HCI (g)
- 3NaBr (s) + H 3 PO 4 (l) → NaH 2 PO 4 (s) + HBr (g)
- 3NaI (s) + H 3 PO 4 (l) → NaH 2 PO 4 (s) + HI (g)
Remoção de ferrugem
O ácido fosfórico pode ser utilizado por aplicação directa de ferro oxidado, ferramentas de aço, ou superfícies para converter ferro (III), óxido de ( ferrugem) a um solúvel em água- composto de fosfato. É normalmente disponível como um líquido esverdeado, adequado para imersão (banho de ácido), mas é mais geralmente usado como um componente em um gel, geleia comumente chamado naval. Como um gel espesso, que pode ser aplicado a superfícies verticais, inclinadas, ou mesmo superiores. Deve ser tomado cuidado para evitar queimaduras de ácido da pele e especialmente os olhos, mas o resíduo é facilmente diluída com água. Quando suficientemente diluído, ele pode até mesmo ser nutritiva à vida vegetal, contendo o fósforo nutrientes essenciais e ferro. Às vezes, é vendido sob outros nomes, tais como "removedor de ferrugem" ou "assassino ferrugem." Não deve ser introduzida directamente nas águas de superfície, tais como riachos ou no sistema de esgotos, no entanto. Após o tratamento, o óxido de ferro castanho-avermelhado será convertido a um preto revestimento composto de fosfato de ferro que pode ser lavado fora. Várias aplicações de ácido fosfórico pode ser necessária para remover toda a ferrugem. O composto resultante preto pode fornecer mais resistência à corrosão (tal proteção é um pouco fornecida pelo superficialmente semelhante Parkerizing e processos electroquímicos azulados de revestimento de conversão). Após a aplicação e remoção de oxidação utilizando compostos de ácido fosfórico, o metal deve ser lubrificada (se a ser usado nua, como em uma ferramenta) ou apropriadamente pintado, usando um processo de revestimento múltiplo de primário, intermediário, e terminar casacos.
Uso de alimentos processados
Ácido fosfórico de qualidade alimentar é usado para acidificar os alimentos e bebidas, tais como várias colas, mas não sem controvérsia a respeito de seus efeitos sobre a saúde. Ele fornece um sabor picante, e, por ser um produto químico produzido em massa, está disponível de forma barata e em grandes quantidades. O baixo custo ea disponibilidade granel é diferente de temperos naturais mais caros que dão sabores comparáveis, como gengibre para tangyness, ou ácido cítrico para acidez, obtido a partir de limões e limes. (Ácido cítrico Entretanto, a maioria na indústria de alimentos não é extraído de frutas cítricas, mas fermentado por Aspergillus niger molde a partir de sucata melaço, resíduos amido hidrolisados e ácido fosfórico.) São designados como E o número E338.
Efeitos biológicos sobre a saúde óssea e cálcio nos rins
Ácido fosfórico, utilizado em muitos refrigerantes (principalmente Cola), tem sido associada a menor densidade óssea em estudos epidemiológicos. Por exemplo, um estudo com dupla energia absortometria de raio-X, em vez de um questionário sobre quebra, fornece evidências razoáveis para apoiar a teoria de que beber resultados cola em baixa densidade óssea. Este estudo foi publicado no American Journal of Clinical Nutrition. Foi estudado um total de 1.672 mulheres e 1.148 homens entre 1996 e 2001. Informações dietéticas foram coletadas através de um questionário de freqüência alimentar que teve perguntas específicas sobre o número de porções de cola e outras bebidas carbonatadas e que também fez uma diferenciação entre regular, caffeine- bebidas grátis, e dieta. O jornal cita evidência estatística significativa para mostrar que as mulheres que consomem cola diariamente têm menor densidade óssea. A ingestão total de fósforo não foi significativamente maior nos consumidores de cola por dia do que nos não consumidores; no entanto, as proporções de cálcio-fósforo foram menores. O estudo também sugere que mais pesquisas são necessárias para confirmar as descobertas.
Por outro lado, um estudo financiado pela Pepsi sugere que a baixa ingestão de fósforo leva a uma menor densidade óssea. O estudo não examina o efeito do ácido fosfórico, que se liga com o magnésio e o cálcio no tracto digestivo para formar sais que não são absorvidos, mas, em vez disso, estuda ingestão geral fósforo.
No entanto, um estudo clínico bem controlado por Heaney e Rafferty usando métodos de cálcio-equilíbrio encontrado nenhum impacto de refrigerantes que contenham ácido phoshporic na excreção de cálcio. O estudo comparou o impacto da água, leite e vários refrigerantes (dois com cafeína e dois sem, duas com ácido fosfórico e dois com ácido cítrico) sobre o balanço de cálcio de 20 a mulheres de 40 anos que habitualmente consumida ~ 3 ou mais copos (680 ml) de uma bebida gaseificada macio por dia. Eles descobriram que, em relação à água, somente o leite e os dois refrigerantes contendo cafeína aumento do cálcio urinário, e que a perda de cálcio associado com o consumo de cafeína refrigerante era aproximadamente igual ao que foi anteriormente encontrada somente para a cafeína. O ácido fosfórico sem cafeína não teve impacto sobre a urina de cálcio, nem aumentar a perda de cálcio urinário relacionado à cafeína. Dado que os estudos demonstraram que o efeito da cafeína é compensado pela redução das perdas de cálcio no final do dia, Heaney e Rafferty concluiu que o efeito líquido de bebidas carbonatadas - incluindo aqueles com cafeína e ácido fosfórico - é insignificante, e que os efeitos de esqueléticos consumo de refrigerantes carbonatados são provavelmente devido principalmente ao leite deslocamento.
Outros produtos químicos, como a cafeína (também um componente significativo de populares bebidas de cola comum) também eram suspeitos como possíveis contribuintes para a baixa densidade óssea, devido ao efeito conhecido da cafeína sobre calciúria. Um outro estudo, composta de 30 mulheres, ao longo de uma semana, sugere que o ácido fosfórico em colas não tem tal efeito, e postula que a cafeína tem apenas um efeito temporário, que é mais tarde revertida. Os autores deste estudo concluem que os efeitos esqueléticos de consumo de bebidas carbonatadas são provavelmente devido principalmente ao deslocamento do leite materno. (Outra possível fator de confusão pode haver uma associação entre alto consumo de refrigerantes e estilo de vida sedentário.)
Consumo Cola também tem sido associada a doença renal e pedras nos rins crónicas através da investigação médica. Este estudo distinção entre os efeitos da cola (em geral, contém ácido fosfórico), sem cola bebidas carbonatadas (ácido cítrico substituto) e café (para o controlo de cafeína), e descobriram que beber dois ou mais refrigerantes por dia mais do que duplicou a incidência de rim doença.
Uso médico
O ácido fosfórico é utilizado em odontologia e Ortodontia como uma solução de gravação, para limpar e encrespar a superfície dos dentes, onde aparelhos dentários ou obturações será colocado. O ácido fosfórico é também um ingrediente em over-the-counter medicamentos anti-náusea que também contêm altos níveis de açúcar ( glucose e frutose). Não deve ser usado por diabéticos sem consulta com um médico. Este ácido também é usado em branqueadores de dentes para eliminar qualquer placa que pode ser sobre os dentes.
Preparação de ácido fosfórico
O ácido fosfórico pode ser preparado por duas vias - o processo térmico como o processo molhado.
Ácido fosfórico térmica: O ácido fosfórico muito puro é obtido por combustão elementar de fósforo para produzir pentóxido de fósforo e dissolvendo o produto em ácido fosfórico diluído. Isto produz um ácido fosfórico muito puro, uma vez que a maioria das impurezas presentes na rocha foram removidas quando se extrai de fósforo a partir da rocha num forno. O resultado final é de qualidade alimentar, ácido fosfórico por via térmica; No entanto, para aplicações críticas, um processamento adicional para remover os compostos de arsénio podem ser necessários.
Wet ácido fosfórico: ácido fosfórico processo húmido é preparada por adição de ácido sulfúrico a fosfato de rocha de cálcio.
A reacção é simplificado:
- 3 H 2 SO 4 + Ca 3 (PO 4) 2 + 6 H2O ↔ 2 H 3 PO 4 + 3 CaSO 4 .2H 2 O
Ácido Wet-processo pode ser purificado através da remoção de flúor para produzir o ácido fosfórico de grau de animais, ou por extracção com solvente e remoção de arsénio para produzir ácido fosfórico de qualidade alimentar.
Outras aplicações
O ácido fosfórico é utilizado como o em electrólito células de combustível de ácido fosfórico. É também usado como um padrão externo de fósforo -31 ressonância magnética nuclear (RMN).
O ácido fosfórico é utilizado como um líquido de limpeza pela ofícios da construção civil para remover depósitos minerais, manchas de cimento, e manchas de água dura. É também usado como um ingrediente em alguns produtos de limpeza domésticos destinadas a tarefas de limpeza semelhantes.
Ácido fosfórico quente é usado em microfabricação para gravar nitreto de silício (Si 3 N 4). É altamente selectiva em gravura de Si 3 N 4, em vez de SiO 2, o dióxido de silício .
O ácido fosfórico é utilizado como um fluxo por amadores (como ferromodelistas) como uma ajuda para a solda.
O ácido fosfórico é também usado nas soluções hidroponia pH para baixar o pH das soluções de nutrientes. Enquanto outros tipos de ácidos pode ser usado, o fósforo é um nutriente utilizada pelas plantas, especialmente durante a floração, tornando ácido fosfórico particularmente desejável. Solução líquida Geral hidroponia pH baixo contém ácido fosfórico, além de ácido cítrico e de bissulfato de amónio, com tampões para manter o pH estável no reservatório de nutrientes.
O ácido fosfórico é usado como um regulador de pH em cosméticos e produtos de cuidados da pele.
O ácido fosfórico é utilizado como um agente químico oxidante para produção de carvão ativado.
