
Éther
Contexte des écoles Wikipédia
Enfants SOS offrent un chargement complet de la sélection pour les écoles pour une utilisation sur les intranets des écoles. Tous les enfants disponibles pour le parrainage de SOS Enfants des enfants sont pris en charge dans une maison de famille près de la charité. Lire la suite ...
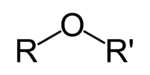
L'éther est une classe de composés chimiques qui contiennent un éther groupe - un oxygène atome relié à deux (substitué) alkyle ou - des groupes aryle de formule générale R-O-R '. Un exemple typique est le solvant et anesthésique l'éther diéthylique, communément appelé simplement "éther" (éthoxyéthane, CH 3 -CH 2 -O-CH 2 -CH 3).
Propriétés physiques
Ether molécules ne peuvent pas former des liaisons hydrogène entre les uns des autres, résultant en un relativement faible point d'ébullition comparable à celle des analogues des alcools . Toutefois, les différences entre les points des éthers à point d'ébullition et de leurs alcools isométriques deviennent plus petites que les chaînes de carbone deviennent plus longs, comme le la nature hydrophobe de la chaîne carbonée devient plus prédominant par rapport à la présence de liaisons hydrogène.
Éthers sont légèrement polaire que le R - C - O - C - angle de liaison de Z dans le groupe fonctionnel est d'environ 110 degrés, et le C - dipôle O ne se annulent. Éthers sont moins polaire que alcènes mais pas aussi polaire que des alcools, esters ou amides de structure comparable. Cependant, la présence de deux paires d'électrons célibataires sur les atomes d'oxygène permet une liaison hydrogène avec des molécules d'eau possibles, ce qui provoque la solubilité des alcools (par exemple, le butan-1-ol) et des éthers (éthoxyéthane) pour être tout à fait différente.
Les éthers cycliques tels que le tétrahydrofuranne et 1,4-dioxane sont totalement miscible à l'eau à cause de l'atome d'oxygène plus exposé à liaison hydrogène par rapport à les éthers aliphatiques.
Éthers peuvent agir comme Les bases de Lewis. Par exemple, l'éther diéthylique forme un complexe avec du bore , tels que les composés le trifluorure de bore éthérate de diéthyle (BF 3. OEt 2). Ethers coordonnent également au magnésium dans Des réactifs de Grignard RMgBr ().
Nomenclature
Dans la nomenclature IUPAC système, les éthers sont nommés en utilisant la formule générale "alkoxy-alcane», par exemple CH 3 -CH 2 -O-CH 3 est méthoxyéthane. Si l'éther fait partie d'une molécule plus complexe, il est décrit comme un substituant alcoxy, de sorte -OCH 3 serait considérée comme une " méthoxy- "groupe. Le plus simple alkyle radical est écrit en avant, de sorte CH 3 -O-CH 2 CH 3 serait donné que méthoxy (CH 3) éthane (CH 2 CH 3). La nomenclature de décrire les deux des groupes alkyle et l'ajout, par exemple "l'éther méthylique d'éthyle" "éther" dans l'exemple ci-dessus, est un utilisation trivial.
Des structures similaires
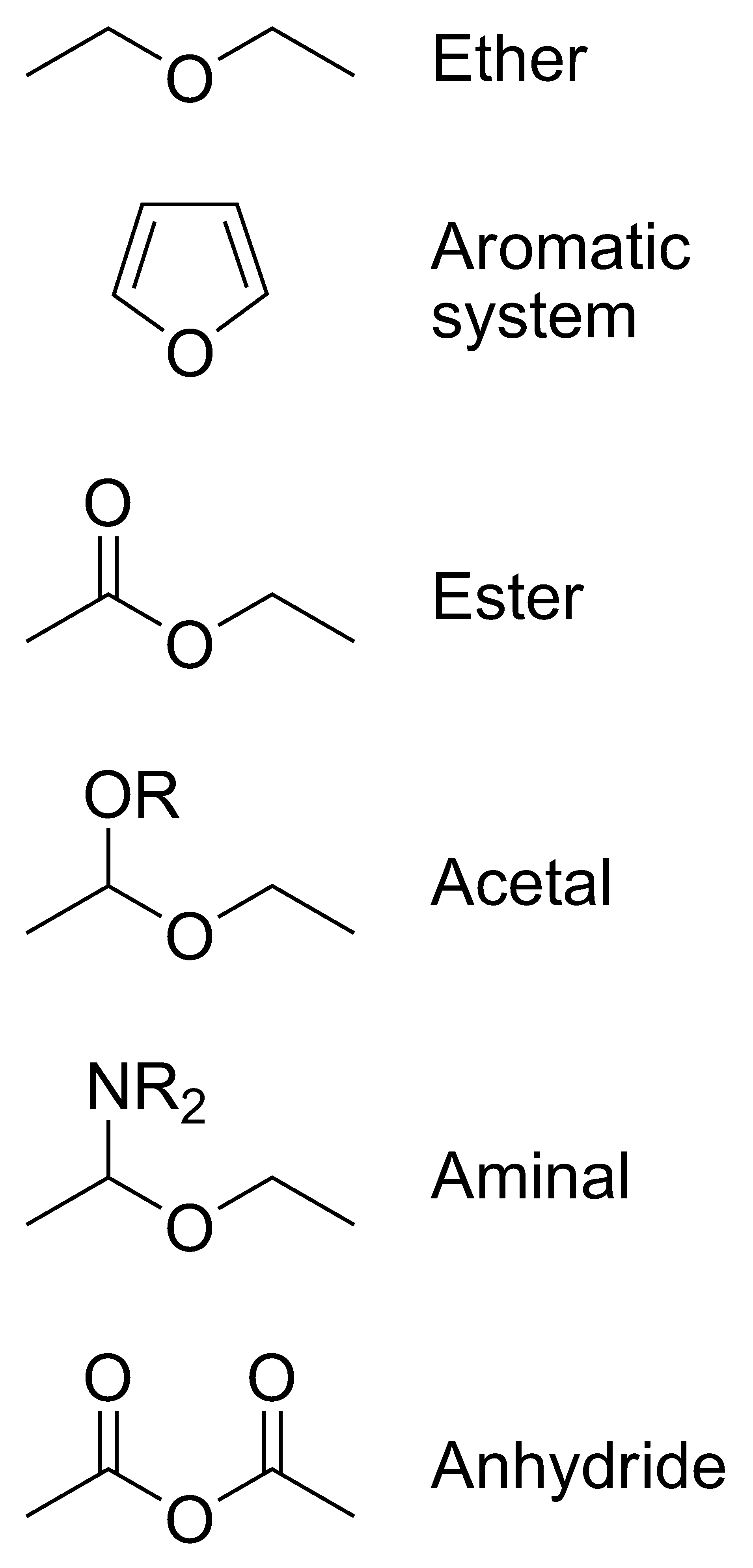
Ethers ne doivent pas être confondus avec les classes suivantes de composés ayant la même structure générale ROR.
- Des composés aromatiques tels que furanne où l'oxygène fait partie du système aromatique.
- Les composés dans lesquels l'un des atomes de carbone à côté de l'oxygène est relié à l'oxygène, l'azote , ou de soufre :
- Esters RC (= O) -OR
- Acétals R-CH (OR) -OR
- Aminals R-CH (NH-R) -OR
- Les anhydrides RC (= O) -OC (= O) -R
Primaire, secondaire, tertiaire et éthers
Les termes "primaire éther", "éther secondaire" et "tertiaire éther" sont parfois utilisés et se réfèrent à l'atome de carbone à côté de l'oxygène d'éther. Dans un éther primaire ce carbone est connecté à un seul autre que le carbone dans l'éther diéthylique CH 3 -CH 2 -O-CH 2 -CH 3. Un exemple d'un éther secondaire est de l'éther diisopropylique (CH 3) 2 CH-O-CH (CH 3) 2 et celle d'un éther tertiaire est éther di-tert-butyl (CH 3) 3 COC (CH 3) 3.
![]()
![]()
![]()
![]()
Diméthyl éther, un primaire, secondaire, tertiaire et d'un éther.
Polyéthers
Les polyéthers sont des composés ayant plus d'un groupe éther. Bien que le terme se réfère généralement à polymères comme le polyéthylèneglycol et polypropylène glycol, des composés de bas poids moléculaire tels que le éthers couronnes peuvent parfois être inclus.
Réactions organiques
Synthèse
Les éthers peuvent être préparés dans le laboratoire de plusieurs manières différentes.
- La déshydratation intermoléculaire des alcools :
- R-OH + R-OH → ROR + H 2 O
- Cette réaction directe nécessite des conditions drastiques (chauffage à 140 degrés Celsius et un catalyseur acide, l'acide sulfurique concentré habituellement). Efficace pour la fabrication des éthers symétriques, mais pas aussi utile pour synthétiser des éthers asymétriques parce que la réaction donne un mélange d'éthers, ce qui rend généralement pas le cas:
- 3R-OH + 3R'-OH → ROR + R'-OU + R'-OR '+ 3 H 2 O
- Les conditions doivent également être contrôlés pour éviter la surchauffe à 170 degrés qui va provoquer la déshydratation intramoléculaire, une réaction qui donne alcènes. En outre, l'alcool doit être en excès.
- R-CH 2 -CH 2 (OH) → R-CH = CH 2 + H 2 O
- Ces conditions peuvent détruire les structures délicates de certains des groupes fonctionnels. Il existe plusieurs méthodes plus douces pour produire des éthers.
- Déplacement nucléophile du des halogénures d'alkyle par alcoxydes
- RO - + RX → ROR + X -
- Cette réaction est appelée la Synthèse d'éther de Williamson. Elle implique le traitement d'un parent de l'alcool avec un fort une base pour former l'alcoolate anions suivie de l'addition d'un composé approprié portant un aliphatique approprié groupe partant (RX). Des groupes appropriés laissant (X) comprennent iodure, bromure, ou sulfonates. Cette méthode ne fonctionne pas si R est aromatique comme dans bromobenzène (Br-C 6 H 5), toutefois, si le groupe partant est séparé par au moins un atome de carbone du benzène, la réaction doit procéder (comme dans Br-CH 2 -C 6 H 5). De même, cette méthode ne donne les meilleurs rendements pour les atomes de carbone primaires, les atomes de carbone secondaires et tertiaires élimination E2 va subir au contact de l'anion alcoolate de base utilisée dans la réaction en raison de l'encombrement stérique des grands groupes alkyle. des éthers d'aryle peuvent être préparées de la Condensation Ullmann.
- Déplacement nucléophile des halogénures alkyle par phénoxydes
- Le RX peut pas être utilisé pour réagir avec l'alcool. Cependant, les phénols peuvent être utilisés pour remplacer l'alcool, tout en maintenant l'halogénure d'alkyle. Depuis phénols sont acides, ils réagissent facilement avec une forte base telle que l'hydroxyde de sodium pour former des ions phénoxyde. L'ion phénoxyde alors remplacer le groupe -X dans l'halogénure d'alkyle, formant un éther avec un groupe aryle attaché à lui dans une réaction avec un Mécanisme SN2.
- HO-C 6 H 5 + OH - → O - C 6 H 5
- O - C 6 H 5 + RX → ROC 6 H 5
- Addition électrophile d'alcools à alcènes .
- R 2 C = CR 2 R-OH + R → 2 CH-C (OR) -R 2
- Acide catalyse est nécessaire pour cette réaction. Souvent, le trifluoroacétate de mercure (Hg (OCOCF 3) 2 est utilisé comme catalyseur pour la réaction, la création d'un éther avec Régiochimie Markovnikov. Tétrahydropyranyle éthers sont utilisés comme les groupes protecteurs pour les alcools.
Éthers cycliques qui sont également connus comme époxydes peuvent être préparés:
- Par oxydation d'alcènes avec un peroxyacide tel que m-CPBA.
- Par la substitution nuclephilic intramoléculaire base d'un halohydrine.
Réactions
Éthers sont en général très faible chimique réactivité. Réactions organiques sont:
- L'hydrolyse.
- Les éthers sont hydrolysé que dans des conditions drastiques comme le chauffage avec tribromure de bore ou en ébullition l'acide bromhydrique. La baisse des acides minéraux contenant un halogène, tels que l'acide chlorhydrique vont cliver les éthers, mais très lentement. L'acide bromhydrique et l'acide iodhydrique sont les deux seuls qui le font à un taux appréciable. Certains éthers aryliques peuvent être clivés par du chlorure d'aluminium .
- Des époxydes, des éthers cycliques ou à cycles à trois chaînons, sont très sensibles à une attaque nucléophile réactif et sont de cette façon.
- Formation de peroxyde.
- Éthers primaires et secondaires avec un groupe CH à côté de l'oxygène d'éther hautement forment facilement explosif les peroxydes organiques (par exemple, diéthyle peroxyde d'éther) en présence d'oxygène, la lumière, et le métal et impuretés aldéhydiques. Pour cette raison, des éthers comme l'éther diéthylique et THF sont généralement évitée solvants dans les procédés industriels
Éthers importants
 | L'oxyde d'éthylène | La plus petite de l'éther cyclique. |
| | Diméthyléther | Une aérosol propulseur. |
| | De l'éther diéthylique | Une faible teneur en solvants d'ébullition commune (pb 34,6 ° C). |
 | Le diméthoxyéthane (DME) | Un solvant à haut point d'ébullition (point d'ébullition 85 ° C): |
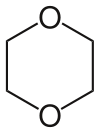 | Dioxane | Un éther cyclique et d'un solvant de haut point d'ébullition (point d'ébullition 101,1 ° C). |
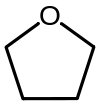 | Le tétrahydrofuranne (THF) | Un éther cyclique, un des plus simples éthers polaires qui est utilisé comme solvant. |
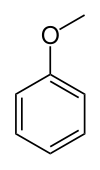 | Anisole (méthoxybenzène) | Un éther d'aryle et un constituant majeur de l' huile essentielle de graines d'anis. |
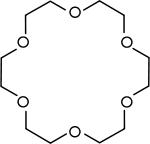 | Éthers de la Couronne | Les polyéthers cycliques qui sont utilisés comme Les catalyseurs de transfert de phase. |
| | Le polyéthylène glycol (PEG) | Un polyéther linéaire, par exemple utilisé dans cosmétiques: |
