Substitution nucléophile
Renseignements généraux
Enfants SOS ont produit une sélection d'articles de wikipedia pour les écoles depuis 2005. Une bonne façon d'aider d'autres enfants est de parrainer un enfant
En organique et chimie inorganique , substitution nucléophile est une classe fondamentale de réactions dans lesquelles un électron nucléophile obligations sélectivement avec ou attaques la charge positive ou partiellement positive d'un atome ou un groupe d'atomes appelé groupe partant; l'atome ou partiellement positif positif est appelé un électrophile.
La forme la plus générale à la réaction peut être donnée quant
- Nuc: + R-LG → R-Nuc + LG:
La paire d'électrons (:) à partir du nucléophile (Nuc) attaque le substrat (R-LG), formant une nouvelle liaison, tandis que le groupe partant (LG) se écarte avec une paire d'électrons. Le produit principal dans ce cas est R-Nuc. Le nucléophile peut être électriquement neutre ou chargé négativement, tandis que le substrat est généralement neutre ou chargé positivement.
Un exemple de substitution nucléophile est le l'hydrolyse d'un alkyl bromure, R -Br, dans des conditions alcalines, où le nucléophile est l'attaque OH - et la groupe partant est Br -.
- R-Br + OH - → R-OH + Br -
Réactions de substitution nucléophile sont monnaie courante en chimie organique, et ils peuvent être classés comme ayant lieu à un saturé carbone aliphatique ou (moins souvent) un cycle saturé centre aromatique carboné non saturé ou d'un autre.
Substitution nucléophile dans les centres de carbone saturés
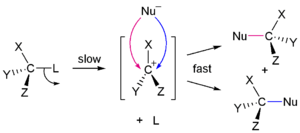
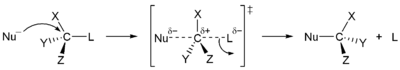
S N 1 et N 2 S réactions
En 1935, Edward D. Hughes et Sir Christopher Ingold a étudié les réactions de substitution nucléophiles de des halogénures d'alkyle et des composés apparentés. Ils ont proposé qu'il y avait deux principaux mécanismes à l'œuvre, tous les deux en concurrence avec l'autre. Les deux principaux mécanismes sont les S 1 N et la réaction N 2 S réaction. S signifie la substitution chimique, N signifie nucléophile, et le nombre représente la Afin cinétique de la réaction.
Dans la réaction de N 2 S, l'addition de l'agent nucléophile et l'élimination du groupe partant ont lieu simultanément. N 2 S se produit lorsque l'atome de carbone central est facilement accessible pour le nucléophile. En revanche, le S N 1 réaction implique deux étapes. S N 1 réactions ont tendance à être importante lorsque l'atome de carbone central du substrat est entouré de groupes volumineux, à la fois parce que ces groupes interfèrent stériquement avec la réaction de S 2 N (discuté ci-dessus) et il se forme en raison de carbone substitués une très stables carbocation.
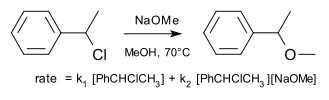
Un exemple d'une réaction de substitution qui se déroule par un mécanisme dit borderline comme étudié l'origine par Hughes et Ingold est la réaction de chlorure de 1-phényléthyle avec méthoxyde de sodium dans du methanol.
La vitesse de réaction se trouve à la somme de S N 1 et N 2 S composants avec 61% (3,5 M, 70 ° C) qui se déroulent par ce dernier.
| Substitution nucléophile sur le carbone | |
|---|---|
 |  |
| 1 S N mécanisme | N 2 S mécanisme |
| Tableau 1. substitutions nucléophiles sur RX (une halogénures d'alkyle ou équivalent) | |||||||
|---|---|---|---|---|---|---|---|
| Facteur | S N 1 | S N 2 | Commentaires | ||||
| Cinétique | Taux = k [RX] | Taux = k [RX] [Noy] | |||||
| Un groupe alkyle primaire | Jamais moins que des groupes supplémentaires de stabilisation présente | Bon à moins un nucléophile à empêchement stérique est utilisé | |||||
| Un groupe alkyle secondaire | Modéré | Modéré | |||||
| Alkyle tertiaire | Excellent | Jamais | Élimination probable si chauffé ou si la base forte utilisée | ||||
| Groupe partant | Important | Important | Pour les halogènes, I> Br> Cl >> F | ||||
| Nucléophilie | Sans importance | Important | |||||
| Preferred solvant | Polaire protique | Polaire aprotique | |||||
| Stéréochimie | Racémisation (+ partielle inversion possible) | Inversion | |||||
| Réarrangements | Commun | Rare | réaction secondaire | ||||
| Éliminations | Commune, en particulier avec des nucléophiles de base | Seulement avec chaleur et base nucléophiles | réaction secondaire esp. si chauffé | ||||
Des réactions de substitution nucléophiles
Il ya de nombreuses réactions en chimie organique qui impliquent ce type de mécanisme. Les exemples communs incluent
- Réductions organiques avec des hydrures, par exemple
- réactions d'hydrolyse tels que
- R-Br + OH - → R-OH + Br - (S N 2) ou
- R-Br + H 2 O → R-OH + HBr (S N 1)
- Synthèse de Williamson
- R-Br + OR '- → R-OR ' + Br - (S N 2)
- Le Synthèse Wenker, une réaction d'aminoalcools anneau de fermeture.
- Le Réaction de Finkelstein, une réaction d'échange d'halogène. Nucléophiles phosphore apparaissent dans le Et la réaction Perkow Réaction de Michaelis-Arbuzov.
- Le La synthèse de Kolbe nitrile, la réaction d'halogénures d'alkyle avec des cyanures.
Autres mécanismes
Outre S N 1 et N 2 S, d'autres mécanismes sont connus, même se ils sont moins fréquents. Le S N i mécanisme est observée dans des réactions de le chlorure de thionyle avec des alcools , et il est similaire à S N 1, sauf que le nucléophile est délivré à partir du même côté que le groupe partant.
Substitutions nucléophiles peuvent être accompagnés d'un réarrangement allylique comme on le voit dans les réactions telles que la Réarrangement Ferrier. Ce type de mécanisme est appelé S N 1 'S ou N 2' réaction (en fonction de la cinétique). Avec des halogénures ou sulfonates allyliques, par exemple, le nucléophile peut attaquer l'atome de carbone insaturé à γ à la place de l'atome de carbone portant le groupe partant. Ceci peut être vu dans la réaction de 1-chloro-2-butène avec de l'hydroxyde de sodium pour donner un mélange de 2-butène-1-ol et 1-butène-3-ol:
- CH 3 CH = CH-CH 2 -Cl → CH 3 CH = CH-CH 2 -OH + CH 3 CH (OH) -CH = CH 2
Le Mécanisme Sn1CB apparaît dans la chimie inorganique . Mécanismes concurrents existent.
Substitution nucléophile dans les centres de carbone insaturés
Substitution nucléophile via le mécanisme 2 S N 1 ou N S ne se produisent généralement avec vinyle ou aryle halogénures ou des composés apparentés. Dans certaines conditions, des substitutions nucléophiles peuvent se produire, par l'intermédiaire d'autres mécanismes tels que ceux décrits dans le article nucléophile de substitution aromatique.
Lorsque la substitution se produit à la un groupe carbonyle, le groupe acyle peut subir substitution nucléophile. Ce est le mode normal de substitution avec des acides carboxyliques dérivés tels que les chlorures d'acyle, esters et amides.