
Helicobacter pylori
Saviez-vous ...
SOS Enfants a fait cette sélection Wikipedia aux côtés d'autres écoles des ressources . Pour comparer les organismes de bienfaisance de parrainage ce est le meilleur lien de parrainage .
| infection à Helicobacter pylori | |
|---|---|
| les ressources de classification et externes | |
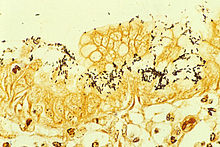
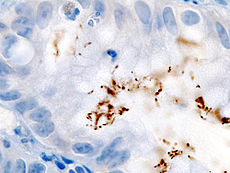 La coloration immunohistochimique de H. pylori à partir d'un biopsie gastrique | |
| CIM 10 | B 98,0 |
| CIM 9 | 041,86 |
| DiseasesDB | 5702 |
| MedlinePlus | 000229 |
| eMedicine | med / 962 |
| MeSH | D016481 |
Helicobacter pylori ( / ˌ h ɛ l ɪ k ɵ b æ k t ər p aɪ l ɔər aɪ /; H. pylori), Campylobacter pyloridis cités précédemment, est un Gram négatif, microaérophile bactérie trouvée dans la estomac. Il a été identifié en 1982 par Barry Marshall et Robin Warren, qui a trouvé que ce était présente chez les patients souffrant de maladies chroniques gastrite et ulcères gastriques, des conditions qui ne ont pas cru auparavant d'avoir un origine microbienne. Il est également lié au développement de ulcères duodénaux et cancer de l'estomac. Cependant, plus de 80 pour cent des personnes infectées par la bactérie sont asymptomatique et il a été postulé qu'il peut jouer un rôle important dans l'écologie naturelle de l'estomac.
Plus de 50% du port de la population de H. du monde pylori dans leur partie supérieure tube digestif. L'infection est plus fréquente dans les pays en développement, et l'incidence est en baisse dans les pays occidentaux. H. forme d'hélice de l 'pylori (dont le générique nom est dérivé) est pensé pour avoir évolué à pénétrer le doublure mucoïde de l'estomac.
Signes et symptômes
Plus de 80% des personnes infectées par H. pylori présentent aucun symptôme. L'infection aiguë peut apparaître comme une maladie aiguë gastrite, avec douleurs abdominales (maux d'estomac) ou nausées. Lorsque cela se développe dans la gastrite chronique, les symptômes, se ils sont présents, sont souvent celles des non ulcéreuse dyspepsie: douleurs à l'estomac, nausées, ballonnements, éructations, et parfois vomissements ou noir selles.
Les personnes infectées par le H. pylori ont un risque à vie de 10 à 20% de développer ulcères gastro-duodénaux et d'un risque de contracter de 1 à 2% cancer de l'estomac. Inflammation de la antre du pylore est plus susceptible de conduire à ulcères duodénaux, tandis que l'inflammation de la corpus (corps de l'estomac) est plus susceptible de conduire à ulcères gastriques et gastrique carcinome. Cependant, il est possible que H. pylori joue un rôle que dans la première étape qui conduit à une inflammation chronique commun, mais pas dans les étapes ultérieures conduisant à la carcinogenèse. Une méta-analyse menée en 2009 a conclu que l'éradication de H. pylori réduit le risque de cancer de l'estomac chez les personnes déjà infectées, ce qui suggère que la présence continue de H. pylori est un facteur de risque de cancer de l'estomac.
Microbiologie
| Helicobacter pylori | |
|---|---|
 | |
| Classification scientifique | |
| Domaine: | Bactéries |
| Embranchement: | Proteobacteria |
| Classe: | Epsilonproteobacteria |
| Ordre: | Campylobacterales |
| Famille: | Helicobacteraceae |
| Genre: | Helicobacter |
| Espèce: | H. pylori |
| Nom binomial | |
| Helicobacter pylori (Marshall et al., 1985) Goodwin et al., 1989 | |
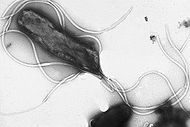
H. pylori est une hélice-forme (classé incurvée tige, pas spirochaete) Bactérie Gram négatif d'environ 3 micromètres de long avec un diamètre d'environ 0,5 micromètres. C'est microaérophile; autrement dit, il nécessite de l'oxygène , mais à une concentration plus faible que se trouve dans l' atmosphère . Il contient un hydrogénase qui peut être utilisé pour obtenir de l'énergie par oxydation moléculaire de l'hydrogène (H 2) produit par les bactéries intestinales. Il produit oxydase, catalase, et uréase. Il est capable de former biofilms et peut convertir en forme de spirale à une éventuellement viables mais non cultivables cocciforme forme, à la fois de nature à favoriser sa survie et être des facteurs dans le épidémiologie de la bactérie.
H. pylori possède cinq majeur protéine de membrane externe (OMP) familles. La plus grande famille connue et comprend putatif adhésines. Les quatre autres familles sont porines, les transporteurs de fer, les protéines associées à flagelle, et des protéines de fonction inconnue. Comme d'autres bactéries à Gram négatif, typiques de la membrane externe de H. pylori est constitué de des phospholipides et lipopolysaccharide (LPS). Le antigène O du LPS peut être Lewis et fucosylés imitent les antigènes de groupes sanguins trouvés sur l'épithélium gastrique. La membrane externe contient également glucosides de cholestérol, qui se trouvent dans quelques autres bactéries. H. pylori a quatre à six lophotrichous flagelles; toutes les espèces de Helicobacter gastriques et entérohépatique sont très mobiles en raison de flagelles. Les filaments gainés flagellaires caractéristiques de Helicobacter sont composés de deux flagellines copolymérisés, FlaA et FlaB.
Génome
H. pylori est constitué d'une grande diversité de souches, et le génomes de trois ont été complètement séquencés. Le génome de la souche "26695" est constitué d'environ 1,7 millions les paires de bases 1550, avec quelques gènes. Les deux souches séquencées montrent de grandes différences génétiques, avec un maximum de 6% de la nucleotides différents.
Etude de la H. pylori génome est centrée sur les tentatives pour comprendre pathogenèse, la capacité de cette organisme à causer une maladie. Environ 29% des loci sont dans la catégorie "pathogenèse» de la base de données de génome. Deux des souches séquencées ont un environ 40- kb de long Cag îlot de pathogénicité (une commune séquence du gène responsable de la pathogenèse cru) qui contient plus de 40 gènes. Cet îlot de pathogénicité est généralement absent de H. pylori souches isolées chez l'homme qui sont porteurs de H. pylori mais restent asymptomatique.
Le gène code cagA pour l'un des principaux H. pylori des protéines de virulence. Les souches bactériennes qui ont le gène cagA sont associées à une capacité à provoquer ulcères. Le gène cagA pour un temps relativement long (1186 acides aminés ) des protéines. L'île de pathogénicité cag (PAI) a environ 30 gènes, dont une partie du code pour un complexe type IV système de sécrétion. Le faible GC-contenu de l'ACG PAI par rapport au reste du génome de Helicobacter suggère l'île a été acquis par transfert horizontal d'une autre espèce bactérienne.
Physiopathologie
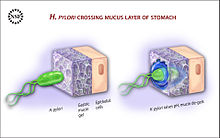
Pour coloniser l'estomac, H. pylori doit survivre le pH acide de la lumen et utiliser son flagelles à se enfouir dans le mucus pour atteindre son niche, à proximité de la couche de cellules épithéliales de l'estomac. De nombreuses bactéries peuvent être trouvés profonde dans le mucus, qui est continuellement sécrétée par les cellules de mucus sécrétant et retirés sur le côté luminal. Pour éviter d'être réalisée dans la lumière, H. pylori détecte le gradient de pH au sein de la couche de mucus par chimiotaxie et nage à l'écart des matières acides de la lumière vers l'environnement de pH plus neutre de la surface des cellules épithéliales. H. pylori se trouve également sur la surface interne de l'estomac les cellules épithéliales et les cellules épithéliales de temps en temps à l'intérieur. Il produit adhésines qui se lient à la membrane associée lipides et des hydrates de carbone et l'aider à adhérer aux cellules épithéliales. Par exemple, le baba d'adhésine se lie à l' antigène Lewis b affichée sur la surface des cellules épithéliales de l'estomac. H. pylori produit de grandes quantités de l'enzyme uréase, les molécules de laquelle sont localisées à l'intérieur et à l'extérieur de la bactérie. L'uréase décompose l'urée (qui est normalement sécrétée dans l'estomac) de dioxyde de carbone et l'ammoniac . L'ammoniac est converti en ammonium par l'acceptation d'un proton (H +), qui neutralise acide gastrique. La survie de H. pylori dans l'estomac acide dépend de l'uréase. L'ammoniac produit est toxique pour les cellules épithéliales, et, avec les autres produits de H. pylori -y compris protéases, vacuolisante cytotoxine A (VacA), et certains phospholipases, - dommages ces cellules.
Les processus inflammatoires de H. pylori infections sont aussi modulées par des protéines hautement ponts disulfure. Helicobacter protéines riches en cystéine (HCP), en particulier HCPA (hp0211), déclenche une réponse immunitaire grâce à la différenciation de l'homme Thp1 myéloïde monocytes en macrophages. Par analogie avec l' eucaryotes cytokines, ils interfèrent avec les fonctions cellulaires de l'hôte et le changement de la morphologie des monocytes, induisant l'expression de la protéine marqueur de surface CD11b, activité phagocytaire, ainsi que l'adhérence des cellules, qui sont indicatifs de la différenciation des monocytes en macrophages.
La colonisation de l'estomac par H. pylori entraîne une gastrite chronique, une inflammation de la muqueuse de l'estomac. La gravité de l'inflammation est susceptible de sous-tendre H. pylori Connexes maladies. Ulcères duodénaux et gastriques se produisent lorsque les conséquences de l'inflammation permettent l'acide et la pepsine dans la lumière de l'estomac pour submerger les mécanismes qui protègent l'estomac et de la muqueuse duodénale de ces substances caustiques. Le type d'ulcère qui se développe dépend de l'emplacement de la gastrite chronique, qui se produit au niveau du site de H. colonisation pylori. L'acidité dans la lumière de l'estomac influence la courbe de colonisation de H. pylori, et donc détermine en dernier ressort si un ulcère duodénal ou gastrique former. Chez les personnes qui produisent de grandes quantités d'acide, H. pylori colonise la antre de l'estomac pour éviter l'acide sécrétant cellules pariétales situées dans la corpus (corps principal) de l'estomac. La réponse inflammatoire induit les bactéries Cellules G dans l'antre de sécréter l'hormone gastrine, qui circule dans le sang au corpus. La gastrine stimule les cellules pariétales de l'corpus encore plus à sécréter de l'acide dans la lumière de l'estomac. Gastrin les niveaux chroniquement augmentation provoquent finalement le nombre de cellules pariétales également augmenter, une aggravation de la quantité d'acide sécrétée. L'augmentation des dommages de charge acide de l'duodénum, et l'ulcération peuvent éventuellement entraîner. En revanche, les ulcères gastriques sont souvent associées à la production d'acide gastrique normale ou réduite, ce qui suggère que les mécanismes protègent la muqueuse gastrique sont défectueux. Chez ces patients, H. pylori peut aussi coloniser le corps de l'estomac, où l'acide sécrétant cellules pariétales sont situés. Cependant inflammation chronique induite par les bactéries entraîne une réduction supplémentaire de la production d'acide et, éventuellement, l'atrophie de la muqueuse de l'estomac, ce qui peut conduire à l'ulcère gastrique et augmente le risque de cancer de l'estomac.
A propos de 50-70% de H. souches pylori dans les pays occidentaux portent l'île de pathogénicité cag (CAG PAI). Patients occidentaux infectés par des souches portant le PAI cag ont une réponse inflammatoire plus forte dans l'estomac et sont à un plus grand risque de développer des ulcères gastro-duodénaux ou cancer de l'estomac que ceux infectés par des souches dépourvues de l'île. À la suite de la fixation de H. pylori à digérer les cellules épithéliales, les système de type IV de sécrétion exprimée par le CAG PAI "injecte" la inflammation agent induisant, peptidoglycane, de leur propre la paroi cellulaire dans les cellules épithéliales. Le peptidoglycane injectée est reconnue par l'cytoplasmique récepteurs de reconnaissance de motifs (capteur immunitaire) Nod1, qui stimule ensuite l'expression de cytokines qui favorisent l'inflammation.
Le type IV Appareil de sécrétion injecte également le PAI cag protéine codée CagA dans les cellules épithéliales de l'estomac, où il perturbe la cytosquelette, adhérence aux cellules adjacentes, la signalisation intracellulaire, la polarité cellulaire, et d'autres activités cellulaires. Une fois à l'intérieur de la cellule, la protéine est CagA phosphorylée sur des résidus de tyrosine par une cellule hôte associée à la membrane tyrosine kinase (TK). CagA puis active allostérique la protéine tyrosine phosphatase / protooncogène Shp2. Souches pathogènes de H. pylori a été démontré pour activer le le récepteur du facteur de croissance épidermique (EGFR), un protéine membranaire avec une tyrosine kinase domaine. L'activation de l'EGFR par H. pylori est associée à une altération transduction du signal et l'expression du gène dans les cellules epitheliales de l'hôte qui peut contribuer à la pathogenèse. Il a également été suggéré qu'un Région C-terminale de la protéine CagA (acides aminés 873 à 1002) peut réguler la cellule hôte la transcription des gènes, indépendamment de la phosphorylation de la protéine tyrosine. Il ya une grande diversité entre les souches de H. pylori, et la souche avec laquelle on est infecté est prédictive du résultat.
Deux mécanismes connexes par lequel H. pylori pourrait promouvoir le cancer sont sous enquête. Un mécanisme implique la production accrue de radicaux libres près de H. pylori et une augmentation du taux de la cellule hôte mutation. L'autre mécanisme proposé a été appelé un «voie perigenetic", et implique la mise en valeur de la cellule hôte phénotype transformé au moyen d'altérations de la cellule des protéines , telles que protéines d'adhésion. H. pylori a été proposé d'induire inflammation locale et les niveaux élevés de TNF-α et / ou l'interleukine 6 (IL-6). Selon le mécanisme proposé perigenetic, des molécules de signalisation associé à une inflammation, tels que le TNF-α, de l'estomac peuvent modifier l'adhérence des cellules épithéliales et conduire à la dispersion et la migration des cellules épithéliales mutés sans la nécessité de mutations supplémentaires dans les gènes suppresseurs de tumeurs, tels que des gènes qui codent pour des protéines d'adhésion cellulaire.
Diagnostic
La colonisation par H. pylori est pas une maladie en soi, mais une condition associée à un certain nombre de troubles de la tractus gastro-intestinal supérieur. Test pour H. pylori est recommandé se il ya ulcère gastro-duodénal, de bas grade gastrique Lymphome du MALT, après résection endoscopique de début cancer de l'estomac, se il ya des parents au premier degré avec le cancer gastrique, et dans certains cas de dyspepsie, pas systématiquement. Plusieurs façons de tester existent. On peut tester de manière non invasive pour H. pylori infection avec un sang anticorps test, selles antigène test ou avec le Test respiratoire à l'urée de carbone (dans lequel le patient boit C-14 ou 13 C marqué à l'urée , qui métabolise la bactérie, produisant marqué dioxyde de carbone qui peut être détecté dans l'haleine). Toutefois, la méthode la plus fiable pour la détection de H. pylori est une infection chèque biopsie cours avec une endoscopie test rapide à l'uréase, examen histologique, et de la culture microbienne. Il existe également une urine Test ELISA avec une sensibilité de 96% et 79% de spécificité. Aucune des méthodes d'essai est complètement à sécurité intégrée. Même biopsie dépend de l'emplacement de la biopsie. tests d'anticorps du sang, par exemple, vont de 76% à 84% sensibilité. Certains médicaments peuvent affecter H. pylori activité uréase et de donner faux négatifs avec les essais à base d'urée.
Prévention
H. pylori est une cause majeure de certaines maladies du tractus gastro-intestinal supérieur. Hausse résistance aux antibiotiques augmente la nécessité de rechercher de nouvelles stratégies thérapeutiques; cela pourrait inclure la prévention sous forme de la vaccination. De vastes études sur les vaccins dans les modèles de souris ont montré des résultats prometteurs. Les chercheurs étudient différents des adjuvants, antigènes, et voies d'immunisation de déterminer le système le plus approprié de protection immunitaire; Cependant, la plupart des recherches que récemment déplacé de l'animal à des essais humains.
Vaccins
Les vaccins contre H. pylori pouvait être utilisée en tant que vaccins prophylactiques pour prévenir l'infection ou en tant que vaccins thérapeutiques pour guérir l'infection, d'améliorer le succès de l'élimination des régimes standard ou de réduire la densité bactérienne dans la muqueuse gastrique et le risque d'apparition de souches résistantes aux antibiotiques. Au cours des dernières années, de nombreuses tentatives, en utilisant divers H. pylori antigènes tels que l'uréase, CagA, NAP-HP, HSPA ou des combinaisons, de nombreux adjuvants et différentes voies d'immunisation ont été faits pour créer des vaccins contre H. infection pylori. Bien que certaines tentatives sont prometteurs, aucun vaccin efficace et sûr contre H. pylori est actuellement disponible pour l'homme. Nouvelles orientations pour l'immunisation avec l'utilisation de l'ADN, vivant vecteurs, etc. microsphères sont en cours d'évaluation. Le plan de vaccination et les groupes qui devraient bénéficier d'une vaccination sont encore à déterminer, mais la vaccination seront utiles, en particulier dans les pays en développement. Une vaccin intramusculaire contre H. pylori infection est en cours La phase I des essais cliniques, et a montré une réponse d'anticorps contre la bactérie. Son utilité clinique nécessite une étude plus approfondie.
Traitement
Une fois H. pylori est détectée chez une personne ayant une ulcère gastro-duodénal, la procédure normale est de l'éradiquer et de permettre l'ulcère de guérir. Le standard traitement de première ligne est une semaine "trithérapie" constitué de Les inhibiteurs de la pompe à protons tels que l'oméprazole et les antibiotiques la clarithromycine et amoxicilline. Les variations de la thérapie triple ont été développés au fil des ans, comme l'utilisation d'un inhibiteur de pompe à protons différent, comme avec pantoprazole ou rabéprazole, ou le remplacement de l'amoxicilline avec métronidazole pour les personnes qui sont allergiques à pénicilline. Un tel traitement a révolutionné le traitement des ulcères gastro-duodénaux et a fait un remède possible à la maladie; précédemment, la seule option était contrôle des symptômes en utilisant antiacides, H 2 antagonistes ou des inhibiteurs de pompe à protons seul.
Un nombre croissant de personnes infectées se trouvent au port bactéries résistantes aux antibiotiques. Cela se traduit par un échec du traitement initial et nécessite des cycles supplémentaires de stratégies de thérapie ou d'autres antibiotiques, comme une quadruple thérapie, ce qui ajoute une bismuth colloïde, comme le sous-salicylate de bismuth. Pour le traitement de souches résistant à la clarithromycine de H. pylori, l'utilisation de lévofloxacine dans le cadre de la thérapie a été suggérée.
Un article dans le American Journal of Clinical Nutrition a trouvé des preuves que «l'ingestion bactéries lactiques exerce un effet inhibiteur sur l'infection à Helicobacter pylori chez les animaux et les humains ", notant que" complétant avec Lactobacillus-et- A été montré contenant Bifidobacterium-de yogourt (AB-yogourt) pour améliorer les taux de l'éradication de H. pylori chez les humains ".
Pronostic
H. pylori colonise l'estomac et induit chronique gastrite, une inflammation de longue durée de l'estomac. La bactérie persiste dans l'estomac pendant des décennies dans la plupart des gens. La plupart des individus infectés par H. pylori sera jamais éprouver des symptômes cliniques malgré gastrite chronique. Environ 10 à 20% de ceux colonisés par H. pylori finira par développer des ulcères gastriques et duodénaux. H. pylori infection est également associée à un risque à vie de 1-2% cancer de l'estomac et un risque d'gastrique inférieur à 1% Lymphome du MALT.
En l'absence de traitement, H. pylori infection une fois établi dans son estomac créneau est largement admis à persister pour la vie. Chez les personnes âgées, cependant, il est probable infection peut disparaître comme la muqueuse de l'estomac devient de plus en plus atrophique et inhospitalier à la colonisation. La proportion des infections aiguës qui persistent est pas connue, mais plusieurs études qui a suivi l'histoire naturelle dans les populations ont signalé l'élimination spontanée apparente.
Une accumulation de preuves suggère que H. pylori a un rôle important dans la protection de certaines maladies. L'incidence de la la maladie de reflux acide, L'oesophage de Barrett, et cancer de l'œsophage ont augmenté de façon spectaculaire en même temps que H. la présence de pylori diminue. En 1996, Martin J. Blaser a avancé l'hypothèse que H. pylori a un effet bénéfique: en régulant l'acidité du contenu de l'estomac. L'hypothèse ne est pas universellement accepté que plusieurs essais contrôlés randomisés ne ont pas démontré une aggravation des symptômes de la maladie de reflux acide suivantes éradication de H. pylori. Néanmoins, Blaser a affiné son point de vue d'affirmer que H. pylori est un membre de la flore normale de l'estomac. Il postule que les changements dans la physiologie gastrique provoquées par la perte de H. pylori compte de l'augmentation récente de l'incidence de plusieurs maladies, y compris le diabète de type 2, l'obésité, et l'asthme . Son groupe a récemment montré que H. colonisation pylori est associée à un plus faible l'incidence de l'asthme infantile.
Survie de H. pylori dépend de transformation et de réparation de l'ADN de recombinaison
La pathogénie de H. pylori dépend de sa capacité à survivre dans l'environnement gastrique sévère caractérisée par l'acidité, le péristaltisme, et l'attaque par les phagocytes accompagnés par la libération d'espèces réactives de l'oxygène. En particulier, H. pylori provoque une réponse de stress oxydatif lors de la colonisation de l'hôte. Cette réponse de stress oxydatif induit adduits de l'ADN oxydantes potentiellement mortelles et mutagènes dans le H. pylori génome.
Comme examiné par Michod et al., La vulnérabilité au stress oxydatif et les dommages oxydatifs à l'ADN se produit couramment dans de nombreux pathogènes bactériens étudiés y compris Neisseria gonorrhoeae, Haemophilus influenzae, Streptococcus pneumoniae, Streptococcus mutans et Helicobacter pylori. Pour chacun de ces agents pathogènes, survivre à la détérioration de l'ADN induites par le stress oxydatif semble être appuyée par transformation médiée réparation par recombinaison. Ainsi, la transformation et la réparation recombinatoire semblent contribuer à l'infection réussie.
Comme le résume le Transformation (génétique), la transformation (le transfert de l'ADN d'une cellule bactérienne à l'autre par l'intermédiaire intervenant) semble faire partie d'une adaptation pour la réparation de l'ADN. H. pylori est naturellement compétente pour la transformation. Alors que de nombreux organismes ne sont compétents que dans certaines conditions environnementales, comme la famine, H. pylori est compétente long de la croissance logarithmique. Comme l'a souligné Dorer et al., Tous les organismes codent programmes génétiques pour réponse à des conditions de stress, y compris ceux qui causent des dommages de l'ADN. En H. pylori, la recombinaison homologue est nécessaire pour la réparation des cassures double brin d'ADN (CDB). Les AddAB résèque complexes hélicase-nucléase CDB et charges RecA SUR DES ADN simple brin (ADNsb), qui assure la médiation puis l'échange de brin, conduisant à la recombinaison homologue et la réparation. L'exigence de RecA ainsi AddAB pour la colonisation gastrique efficace suggère que dans le H. de l'estomac pylori est soit exposé à des dégâts double brin d'ADN qui doit être réparé ou nécessite un autre événement de recombinaison médiée. En particulier, la transformation naturelle est augmentée par des dommages de l'ADN chez H. pylori et Dorer et al. trouvé un lien entre la réponse aux dommages de l'ADN et l'absorption d'ADN chez H. pylori, ce qui suggère que la compétence naturelle contribue à la persistance de H. pylori dans son hôte humain et explique le maintien de la compétence dans la plupart des isolats cliniques.
RuvC protéines est essentielle pour le processus de réparation par recombinaison car il résout intermédiaires dans ce processus appelés jonctions de Holliday. H. pylori mutants qui sont défectueux dans RuvC ont une sensibilité accrue aux agents endommageant l'ADN et au stress oxydatif, exposition réduit la survie dans les macrophages, et sont incapables d'établir infection réussie dans un modèle de souris. De même, la protéine recN joue un rôle important dans la réparation ORD dans H. pylori. Une H. pylori recN mutant affiche une capacité atténuée de coloniser l'estomac de souris, soulignant l'importance de recombinaison réparation de l'ADN dans la survie de H. pylori dans son hôte.
Épidémiologie
Au moins la moitié de la population mondiale sont infectés par la bactérie, ce qui rend l'infection la plus répandue dans le monde. Les taux d'infection réels varient d'une nation à; la le monde en développement a des taux d'infection beaucoup plus élevés que l'Occident ( Europe de l'Ouest, Amérique du Nord , Australasie), où les taux sont estimés à environ 25%. L'âge auquel cette bactérie est acquis semble influencer l'issue possible pathologique de l'infection: les personnes infectées avec elle à un âge précoce sont susceptibles de développer une inflammation plus intense qui peut être suivi par une gastrite atrophique avec un risque ultérieur plus élevé d'ulcère gastrique, cancer de l'estomac ou les deux. Acquisition à un âge plus gastrique apporte différents changements plus susceptibles de conduire à un ulcère duodénal. Les infections sont généralement acquises dans la petite enfance dans tous les pays. Cependant, le taux d'infection des enfants dans les pays en développement est plus élevé que dans pays industrialisés, probablement due à de mauvaises conditions sanitaires. Dans les pays développés, il est actuellement rare de trouver des enfants infectés, mais le pourcentage de personnes infectées augmente avec l'âge, avec environ 50% pour ceux infectés âgés de plus de 60 comparativement à environ 10% entre 18 et 30 ans. La prévalence plus élevée chez les personnes âgées reflète la hausse des taux d'infection quand ils étaient enfants plutôt que l'infection à un âge avancé. Aux États-Unis, la prévalence semble plus élevée dans Afro-américaine et Populations hispaniques, probablement en raison de facteurs socio-économiques. La baisse du taux d'infection dans l'Ouest est en grande partie attribuable à des normes d'hygiène élevés et l'utilisation répandue des antibiotiques. Malgré des taux élevés d'infection dans certaines régions du monde, la fréquence globale de H. pylori infection diminue. Cependant, résistance aux antibiotiques apparaît dans H. pylori; Il ya déjà beaucoup metronidazole- et clarithromycine souches résistantes dans la plupart des régions du monde.
H. pylori est contagieuse, bien que la voie de transmission exact ne est pas connu. La transmission de personne à personne par les voies orale-orale ou voie fécale-orale est la plus probable. Conformément à ces voies de transmission, les bactéries ont été isolées à partir de les matières fécales, salive et la plaque dentaire de certaines personnes infectées. Les résultats suggèrent que H. pylori se transmet plus facilement via le mucus gastrique que par la salive La transmission se fait principalement au sein des familles dans les pays développés mais peut également être acquis de la communauté dans les pays en développement. H. pylori peut également être transmis oralement par des moyens de matière fécale par l'ingestion d'eau des déchets contaminé, donc un environnement hygiénique pourrait aider à diminuer le risque de H. infection pylori.
Évolution
Helicobacter pylori migré hors de l'Afrique avec son hôte humain il ya environ 60000 années. Son évolution ultérieure a créé sept prototypes-Europe (isolé à partir de l'Europe, le Moyen-Orient, l'Inde et l'Iran), NE Afrique (Afrique du Nord), Afrique1 (des pays d'Afrique de l'Ouest et Afrique du Sud), Afrique2 (Afrique du Sud), Asie2 (Inde du Nord et parmi les isolats du Bangladesh, de la Thaïlande et de la Malaisie), Sahul (à partir Aborigènes d'Australie et la Papouasie-Nouvelle-Guinée) et Asie de l'Est avec les sous-populations E Asie (à partir Asiatiques de l'Est), les Maoris (à partir Autochtones taïwanais, Mélanésiens et Polynésiens) et Amerind (Amérindiens). Les précurseurs de ces prototypes ont été nommés Europe1 ancestrale, Europe2 ancestrale, l'Asie ancestrale Orient, Afrique 1 ancestrale, Afrique2 ancestrale et Sahul ancestrale. Ces prototypes ancestrales semblent provenir en Afrique, Asie centrale et orientale. Souches européennes et africaines ont été introduits dans les Amériques avec ses colonisation-deux milliers d'années il ya en plus recently- la traite des esclaves.
États de recherche récents qui la diversité génétique des H. pylori augmente avec la distance géographique de l'Afrique orientale , le berceau de l'homme moderne. En utilisant les données de la diversité génétique, les chercheurs ont créé des simulations qui indiquent les bactéries semblent avoir propager d'Afrique de l'Est il ya environ 58000 années. Leurs résultats indiquent les humains modernes étaient déjà infectés par H. pylori avant leurs migrations hors d'Afrique, et il est resté associé à des hôtes humains depuis ce temps.
Histoire
Helicobacter pylori a été découvert dans l'estomac des patients souffrant de gastrite et les ulcères d'estomac en 1982 par le Dr Barry Marshall et le Dr Robin Warren, de Perth, en Australie occidentale . À l'époque, la pensée conventionnelle était qu'aucune bactérie peut vivre dans l'estomac humain, que l'estomac produit des quantités importantes d'acide d'une force similaire à l'acide trouvés dans un batterie de voiture. Marshall et Warren ont réécrit les manuels en référence à ce qui cause la gastrite et les ulcères gastriques. En reconnaissance de leur découverte, ils ont reçu le 2005 Prix Nobel de physiologie ou médecine.
Précédent de recherche de Marshall et Warren, les scientifiques allemands ont trouvé en forme de spirale bactéries dans la muqueuse de l'estomac humain en 1875, mais ils ont été incapables de la culture, et les résultats ont finalement été oubliés. Le chercheur italien Giulio Bizzozero décrit bactéries de forme similaire vivant dans l'environnement acide de l'estomac de chiens en 1893. Professeur Walery Jaworski de la Université Jagellonne de Cracovie étudié les sédiments de lavages gastriques obtenus à partir de l'homme en 1899. Parmi certaines bactéries en forme de bâtonnets, il a également trouvé des bactéries avec une forme en spirale caractéristique, qu'il a appelé Vibrio rugula. Il a été le premier à suggérer un rôle possible de cet organisme dans la pathogenèse des maladies gastriques. Ce travail a été inclus dans le Manuel des maladies gastriques, mais il y avait peu d'impact, comme il a été écrit en polonais. Plusieurs petites études menées au début du 20e siècle ont démontré la présence de tiges courbées dans l'estomac de nombreux patients souffrant d'ulcères gastro-duodénaux et cancer de l'estomac. L'intérêt pour les bactéries décliné, cependant, quand une étude américaine publiée en 1954 n'a pas respecté les bactéries dans 1 180 biopsies de l'estomac.
Intérêt à comprendre le rôle des bactéries dans les maladies de l'estomac a été ravivé dans les années 1970, avec la visualisation de bactéries dans l'estomac des patients atteints d'ulcère gastrique. La bactérie a également été observé en 1979, par le pathologiste australien Robin Warren, qui a fait des recherches plus poussées sur elle avec médecin australien Barry Marshall à partir de 1981. Après de nombreuses tentatives infructueuses de culture des bactéries de l'estomac, ils ont finalement réussi à colonies visualisation en 1982, quand ils ont quitté involontairement leur Des boîtes de Pétri en incubation pendant 5 jours sur la Pâques week-end. Dans leur document d'origine, Warren et Marshall ont soutenu que la plupart des ulcères de l'estomac et des gastrites ont été causés par une infection par cette bactérie et non par stress ou la nourriture épicée, comme cela avait été supposé auparavant.
Bien qu'il y ait un certain scepticisme au départ, au sein de plusieurs années, de nombreux groupes de recherche ont vérifié l'association de H. pylori avec la gastrite et, dans une moindre mesure, des ulcères. Pour démontrer H. pylori causé la gastrite et ne était pas seulement un spectateur, Marshall a bu un bécher de H. culture pylori. Il est tombé malade avec des nausées et des vomissements plusieurs jours plus tard. Une endoscopie dix jours après l'inoculation a révélé des signes de gastrite et la présence de H. pylori. Ces résultats suggèrent H. pylori est l'agent causal de la gastrite. Marshall et Warren ont continué à démontrer que les antibiotiques sont efficaces dans le traitement de nombreux cas de gastrite. En 1987, le Sydney gastroentérologue Thomas Borody a inventé la première trithérapie pour le traitement des ulcères duodénaux. En 1994, le National Institutes of Health (USA) a publié un avis indiquant duodénale les plus récurrentes et les ulcères gastriques ont été causés par H. pylori, et recommandées antibiotiques être inclus dans le régime de traitement.
La bactérie a été initialement nommé pyloridis Campylobacter, puis rebaptisée C. pylori (pylori étant le génitif pylore) pour corriger une Erreur de grammaire latine. Quand ARN ribosomique 16S séquençage de gènes et d'autres recherches ont montré en 1989 que la bactérie ne appartenait pas dans le genre Campylobacter, il a été placé dans son propre genre , Helicobacter. Le genre dérivé du grec ancien Helix / έλιξ «spirale» ou «bobine». Les moyens de l'épithète spécifique "du pylore" ou valve pylorique (l'ouverture circulaire qui part de l'estomac dans le duodénum), de l'ancien mot grec πυλωρός, ce qui signifie gatekeeper.
