
Helicobacter pylori
Você sabia ...
Crianças SOS feita esta seleção Wikipedia ao lado de outras escolas recursos . Para comparar instituições de caridade de patrocínio esta é a melhor ligação de patrocínio .
| Infecção por Helicobacter pylori | |
|---|---|
| Classificação e recursos externos | |
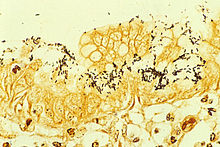
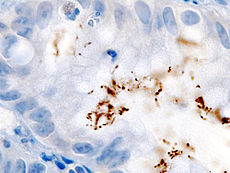 Coloração imuno-histoquímica de H. pylori de uma biópsia gástrica | |
| CID- 10 | B 98,0 |
| CID- 9 | 041,86 |
| DiseasesDB | 5702 |
| MedlinePlus | 000229 |
| Medcenter | med / 962 |
| MeSH | D016481 |
Helicobacter pylori ( / ˌ h ɛ l ɪ k ɵ b æ k t ər p aɪ l ɔər aɪ /; H. pylori), pyloridis Campylobacter, previamente nomeados, é uma Gram-negativa, microaerofilia bactéria encontrada na estômago. Ele foi identificado em 1982 por Barry e Marshall Robin Warren, que descobriu que ele estava presente em pacientes com doenças crônicas e gastrite úlceras gástricas, condições que não foram anteriormente acreditava ter um causa microbiana. Ela está também relacionada com o desenvolvimento de úlceras duodenais e câncer de estômago. No entanto, mais de 80 por cento dos indivíduos infectados com a bactéria são assintomática e tem sido postulado que podem desempenhar um importante papel na ecologia natural, estômago.
Mais do que 50% da população do mundo porto H. pylori na sua parte superior trato gastrointestinal. A infecção é mais prevalente nos países em desenvolvimento, ea incidência está diminuindo nos países ocidentais. H. forma de hélice pylori 's (da qual o genérico nome é derivado) é pensado para ter evoluído para penetrar na revestimento mucoso do estômago.
Os sinais e sintomas
Mais de 80% das pessoas infectadas com H. pylori não apresentam sintomas. A infecção aguda pode aparecer como uma aguda gastrite com dor abdominal (dor de barriga) ou náusea. Quando esta se desenvolve em gastrite crónica, os sintomas, se presente, são muitas vezes as de não ulcerosa dispepsia: dores de estômago, náuseas, inchaço, arroto, e às vezes vómitos ou preto fezes.
Os indivíduos infectados com H. pylori têm um risco de vida de 10 a 20% de desenvolver úlceras pépticas e um risco de 1 a 2% de aquisição câncer de estômago. Inflamação da antro pilórico é mais susceptível de conduzir a úlceras duodenais, enquanto que a inflamação do corpus (corpo do estômago) é mais susceptível de conduzir a úlceras gástricas e gástrica carcinoma. No entanto, é possível que o H. pylori desempenha um papel apenas na primeira fase, que conduz à inflamação crónica comum, mas não em outras fases que conduzem a carcinogénese. Uma meta-análise realizada em 2009 concluiu que a erradicação da H. pylori reduz o risco de câncer gástrico em indivíduos previamente infectados, sugerindo que a presença contínua da H. pylori é um fator de risco para câncer gástrico.
Microbiologia
| Helicobacter pylori | |
|---|---|
 | |
| Classificação científica | |
| Domínio: | Bactérias |
| Filo: | Proteobacteria |
| Classe: | Epsilonproteobacteria |
| Ordem: | Campylobacterales |
| Família: | Helicobacteraceae |
| Género: | Helicobacter |
| Espécie: | H. pylori |
| Nome binomial | |
| Helicobacter pylori (Marshall et al., 1985) Goodwin et al., 1989 | |
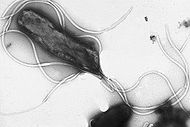
H. pylori é uma em forma de hélice (classificada como uma curva haste, não spirochaete) Bactéria gram-negativa de cerca de 3 micrómetros de comprimento, com um diâmetro de cerca de 0,5 micrómetros. É microaerophilic; isto é, que requer oxigénio , mas a uma concentração mais baixa do que a encontrada na atmosfera . Ele contém um hidrogenase que pode ser usado para obter energia por oxidação molecular de hidrogénio (H2) produzido pela bactérias intestinais. Produz oxidase, catalase, e urease. Ele é capaz de formar biofilmes e pode converter de espiral para um possivelmente viável, mas nonculturable cocóide forma, tanto susceptível de favorecer a sua sobrevivência e ser fatores na epidemiologia da bactéria.
H. pylori possui cinco grandes proteína da membrana externa (OMP) famílias. A maior família inclui conhecida e putativo adesinas. Os outros quatro famílias são porins, transportadores de ferro, proteínas associadas ao flagelo, e proteínas de função desconhecida. Tal como outras bactérias Gram-negativas típicas, da membrana exterior de H. pylori consiste e fosfolípidos lipopolissacarídeo (LPS). O O antigénio pode ser de LPS fucosilado e mímicos de Lewis antigénios dos grupos sanguíneos encontrado no epitélio gástrico. A membrana exterior também contém glucósidos de colesterol, que são encontrados em algumas outras bactérias. H. pylori tem 4-6 lophotrichous flagelos; todas as espécies de Helicobacter gástricas e entero-hepática são altamente móveis, devido ao flagelos. Os característicos filamentos flagelar bainha de Helicobacter são compostas por dois flagelinas copolimerizados, FlaA e FlaB.
Genoma
H. pylori é constituída por uma grande diversidade de estirpes, e o genomas de três foram completamente sequenciado. O genoma da estirpe de "26695" consiste de cerca de 1,7 milhões pares de bases, com algumas 1550 genes. As duas estirpes sequenciadas mostram grandes diferenças genéticas, com um máximo de 6% da nucleotídeos diferentes.
Estudo da H. pylori genoma está centrado na tentativa de compreender patogénese, a capacidade deste organismo para causar a doença. Cerca de 29% dos loci estão na categoria "patogênese" da base de dados do genoma. Duas das estirpes sequenciadas possuem um aproximadamente 40- kb de comprimento Cag ilha de patogenicidade (a comum sequência do gene acreditava responsável pela patogênese) que contém mais de 40 genes. Esta ilha de patogenicidade está normalmente ausente do H. pylori estirpes isoladas de humanos que são portadores de H. pylori mas permanecem assintomática.
O códigos do gene cagA para um dos principais H. pylori proteínas de virulência. As estirpes bacterianas que possuem o gene cag estão associados a uma capacidade para causar úlceras. O gene cagA para uma relativamente longa (1186 aminoácido ) proteína. A ilha cag de patogenicidade (PAI) tem cerca de 30 genes, parte do qual código para um complexo escreva IV sistema de secreção. A baixa GC-conteúdo do cag PAI em relação ao resto do genoma Helicobacter sugere a ilha foi adquirida pela transferência horizontal de outras espécies bacterianas.
Fisiopatologia
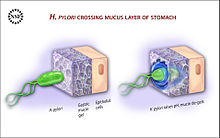
Para colonizar o estômago, H. pylori devem sobreviver ao pH ácido do lúmen e usar sua flagelos para enterrar-se no muco para atingir o seu nicho, perto de camada de células epiteliais do estômago. Muitas bactérias podem ser encontradas no fundo do muco, que é continuamente secretada pelas células secretoras de muco e removidos no lado luminal. Para evitar a ser levada para o lúmen, H. pylori detecta o gradiente de pH dentro da camada de muco por quimiotaxia e nada para longe a partir do conteúdo ácido do lúmen para o ambiente de pH mais neutro da superfície de células epiteliais. H. pylori também é encontrado na superfície interna do estômago células epiteliais e, ocasionalmente, no interior das células epiteliais. Produz adesinas que se ligam a associada à membrana de lipídios e carboidratos e ajudá-la a aderir às células epiteliais. Por exemplo, o BabA adesina se liga ao antigénio Lewis b exibida na superfície das células epiteliais do estômago. H. pylori produz grandes quantidades da enzima urease, as moléculas de que estão localizadas no interior e no exterior da bactéria. A urease decompõe a ureia (que é normalmente segregada para o estômago) para dióxido de carbono e amoníaco . O amoníaco é convertido em amónio por aceitar um protão (H +), que neutraliza ácido gástrico. A sobrevivência de H. pylori no estômago ácido é dependente da urease. O amoníaco produzido é tóxico para as células epiteliais, e, juntamente com outros produtos de H. pylori -inclusive proteases, citotoxina vacuolar A (VacA) e, em certa fosfolipases, - danos nessas células.
Processos inflamatórios de H. infecções pylori, também são mediados por proteínas altamente dissulfito em ponte. Helicobacter proteínas ricas em cisteína (PCH), particularmente HCPA (hp0211), desencadeia uma resposta imunitária através da diferenciação de humano THP1 mielóide monócitos em macrófagos. Em analogia com o eucariota citocinas, eles interferem com as funções das células hospedeiras e alterar a morfologia de monócitos, induzindo a expressão da proteína de superfície do marcador CD11b, actividade fagocitária, bem como a adesão de células, que são indicativas de diferenciação de monócitos em macrófagos.
A colonização do estômago por H. pylori resulta em gastrite crônica, uma inflamação do revestimento do estômago. A gravidade da inflamação é provável que estão subjacentes H. pylori relacionados com doenças. Úlceras duodenais e gástricas resultar quando as conseqüências da inflamação permitir que o ácido e pepsina no lúmen do estômago para subjugar os mecanismos que protegem o estômago e na mucosa duodenal destas substâncias cáusticas. O tipo de úlcera que se desenvolve depende da localização da gastrite crónica, que ocorre no local de H. colonização pylori. A acidez dentro do lúmen do estômago afecta o padrão de colonização da H. pylori, e, portanto, em última instância, determina se uma úlcera duodenal ou gástrica vai formar. Em pessoas que produzem grandes quantidades de ácido, H. pylori coloniza a antro do estômago para evitar o ácido-secretora células parietais localizados no corpus (corpo principal) do estômago. A resposta inflamatória que induz as bactérias Células G do antro a secretar o hormônio gastrina, que viaja através da corrente sanguínea para o corpus. Gastrina estimula as células parietais do corpus a secretar ainda mais ácido no lúmen do estômago. Cronicamente aumentados os níveis de gastrina eventualmente fazer com que o número de células parietais também para aumentar, aumentando ainda mais a quantidade de ácido segregado. O aumento dos danos de carga de ácido duodeno, e ulceração podem eventualmente resultar. Em contraste, as úlceras gástricas são frequentemente associados com a produção de ácido gástrico normal ou reduzida, o que sugere que os mecanismos de protecção da mucosa gástrica são defeituosos. Nestes pacientes, H. pylori também pode colonizar o corpo do estômago, onde o ácido-secretora células parietais estão localizados. No entanto inflamação crónica induzida pela bactéria provoca nova redução da produção de ácido e, eventualmente, atrofia da mucosa do estômago, o que pode levar a úlcera gástrica e aumenta o risco de câncer de estômago.
Cerca de 50-70% de H. cepas pylori em países ocidentais levar a ilha cag de patogenicidade (cag PAI). Pacientes ocidentais infectados com cepas portadoras do cag PAI tem uma resposta inflamatória mais forte no estômago e estão em maior risco de desenvolver úlceras pépticas ou câncer de estômago do que aqueles infectados com cepas falta da ilha. Após a ligação da H. pylori de estômago células epiteliais, os Tipo de sistema de secreção IV expressa pelo cag PAI "injeta" o agente de indução de inflamação, peptidoglycan, a partir de sua própria parede celular nas células epiteliais. O peptidoglicano injectado é reconhecido pelo citoplasmática receptor de reconhecimento de padrões (sensor imunológico) Nod1, que então estimula a expressão de citocinas que promovem inflamação.
O tipo IV aparelho de secreção também injeta a cag-PAI codificado CagA proteína em células epiteliais do estômago, onde ele interrompe o citoesqueleto, a adesão às células adjacentes, sinalização intracelular, da polaridade celular, e outras actividades celulares. Uma vez dentro da célula, a proteína CagA é fosforilada em resíduos de tirosina por uma associada à membrana celular do hospedeiro tirosina quinase (TK). CagA então ativa alostericamente proteína-tirosina-fosfatase / proto-oncogene Shp2. Cepas patogênicas de H. pylori têm sido mostrados para activar o factor de crescimento epidérmico (EGFR), um proteína de membrana com uma tirosina cinase domínio. A activação do EGFR por H. pylori está associado a alteração transdução de sinal e a expressão do gene em células epiteliais do hospedeiro, que pode contribuir para a patogénese. Também tem sido sugerido que uma Região C-terminal da proteína CagA (aminoácidos 873-1002) pode regular a célula hospedeira transcrição do gene, independente da fosforilação da tirosina da proteína. Há uma grande diversidade entre estirpes de H. pylori, ea tensão com o qual se está infectado é preditiva do resultado.
Dois mecanismos relacionados pelo qual H. pylori poderiam promover câncer estão sob investigação. Um mecanismo envolve a produção aumentada de radicais livres próximos H. pylori e um aumento da taxa de célula hospedeira mutação. O outro mecanismo proposto tem sido chamado de uma "via perigenetic", e envolve o aumento do fenótipo da célula hospedeira transformada por meio de alterações em células de proteínas , tais como proteínas de adesão. H. pylori tem sido proposta para induzir inflamação e altos níveis de localmente TNF-α e / ou interleucina 6 (IL-6). De acordo com o mecanismo proposto perigenetic, moléculas de sinalização associadas à inflamação, tais como TNF-α, pode alterar a adesão de células epiteliais gástricas e levar a dispersão e migração de células epiteliais mutados sem a necessidade de mutações adicionais em genes supressores de tumores, tais como genes que codificam para proteínas de adesão celular.
Diagnóstico
A colonização com H. pylori não é uma doença, por si só, mas de um estado associado com um número de distúrbios do tracto gastrointestinal superior. Testes para H. pylori é recomendado se houver úlcera péptica, gástrico de baixo grau Linfoma MALT, após a ressecção endoscópica de início cancro gástrico, se houver parentes de primeiro grau com cancro gástrico, e em certos casos de dispepsia, não rotineiramente. Várias formas de testes de existir. Pode-se testar de forma não invasiva para H. pylori com um sangue anticorpo teste, fezes antígeno teste, ou com o teste respiratório com uréia carbono (em que o paciente bebe 14 C-ou 13 marcado com C ureia , que a bactéria metaboliza, produzindo marcado dióxido de carbono que pode ser detectado na respiração). No entanto, o método mais fiável para a detecção de H. pylori é uma verificação de biópsia durante endoscopia com um teste rápido da urease, exame histológico e cultura microbiana. Há também uma urina Teste ELISA com uma sensibilidade de 96% e 79% de especificidade. Nenhum dos métodos de ensaio é completamente à prova de falhas. Mesmo biópsia é dependente da localização da biópsia. Os testes de anticorpos do sangue, por exemplo, variar de 76% a 84% sensibilidade. Algumas drogas podem afetar H. pylori actividade da urease e dar- falsos negativos com os testes à base de uréia.
Prevenção
H. pylori é uma das principais causas de certas doenças do tracto gastrointestinal superior. Ascendente a resistência aos antibióticos aumenta a necessidade de busca de novas estratégias terapêuticas; isso pode incluir a prevenção na forma de vacinação. Estudos de vacinas extensos em modelos de ratos têm mostrado resultados promissores. Os pesquisadores estão estudando diferentes adjuvantes, antígenos, e vias de imunização para verificar o sistema mais adequado de proteção imunológica; no entanto, a maioria das pesquisas apenas recentemente se mudou de animal para testes em humanos.
Vacinas
As vacinas contra H. pylori podem ser utilizados como vacinas profiláticas para prevenir a infecção ou como vacinas terapêuticas para curar a infecção, para melhorar o sucesso da erradicação regimes padrão ou para reduzir a densidade bacteriana na mucosa gástrica e o risco de aparecimento de estirpes resistentes a antibióticos. Nos últimos anos, muitas tentativas, utilizando vários H. antígenos pylori, tais como urease, CagA, HP-NAP, HspA ou combinações, muitas adjuvantes e diferentes vias de imunização foram feitas para criar vacinas contra H. pylori. Apesar de algumas tentativas são promissores, nenhuma vacina eficaz e segura contra H. pylori é actualmente disponíveis para os seres humanos. Novas indicações para a imunização com o uso de DNA, vectores vivos, microesferas etc, são actualmente a ser avaliada. O plano de vacinação e os grupos que devem receber vacinação estão ainda a ser determinado, mas a vacinação será útil, especialmente em países em desenvolvimento. Um vacina intramuscular contra H. pylori está passando Fase I de ensaios clínicos, e tem se mostrado uma resposta de anticorpos contra a bactéria. Sua utilidade clínica requer um estudo mais aprofundado.
Tratamento
Uma vez que H. pylori é detectado em uma pessoa com um úlcera péptica, o procedimento normal é de erradicá-la e permitir a cura da úlcera. A norma A terapia de primeira linha é uma semana "terapia tripla", que consiste Os inibidores da bomba de protões, tais como omeprazole e os antibióticos claritromicina e amoxicilina. Variações da terapia tripla foram desenvolvidos ao longo dos anos, como o uso de um inibidor de bomba de próton diferente, como acontece com pantoprazol ou rabeprazole, ou substituir com amoxicilina metronidazol para pessoas que são alérgicas a penicilina. Tal terapia revolucionou o tratamento de úlceras pépticas e fez uma cura para a doença possível; anteriormente, a única opção era o controlo dos sintomas usando antiácidos, H 2 antagonistas ou inibidores da bomba de protões sozinho.
Um número crescente de indivíduos infectados são encontrados para abrigar bactérias resistentes a antibióticos. Isto resulta na falha do tratamento inicial e requer ciclos adicionais de terapia ou estratégias alternativas, tais como antibióticos, uma terapêutica quádrupla, o que acrescenta uma bismuto coloidal, tal como subsalicilato de bismuto. Para o tratamento de cepas resistentes à claritromicina de H. pylori, a utilização de levofloxacina, como parte da terapia foi sugerido.
Um artigo no American Journal of Clinical Nutrition descobriu evidências de que "a ingestão de bactérias produtoras de ácido láctico exerce um efeito supressor sobre a infecção por Helicobacter pylori em animais e seres humanos ", observando que" suplementar com Lactobacillus-e- Foi mostrado contendo Bifidobacterium iogurte (AB-iogurte) para melhorar as taxas de erradicação do H. pylori em seres humanos ".
Prognóstico
H. pylori coloniza o estômago e induz crônica gastrite, uma inflamação de longa duração do estômago. A bactéria persistir no estômago durante décadas na maioria das pessoas. A maioria dos indivíduos infectados pelo H. pylori nunca vai experimentar sintomas clínicos, apesar de ter gastrite crônica. Aproximadamente 10-20% dos colonizado por H. pylori acabará por desenvolver úlceras gástricas e duodenais. H. pylori infecção também está associada com um risco de vida de 1-2% cancro do estômago e um risco menor do que 1% de gástrico Linfoma MALT.
Na ausência de tratamento, H. -infecção uma vez pylori estabelecida em seu nicho-gástrico é amplamente considerado como persistir por toda a vida. Nos idosos, no entanto, é provável que a infecção pode desaparecer à medida que a mucosa do estômago torna-se cada vez mais atrófica e inóspito à colonização. A proporção de infecções agudas que persistem não é conhecida, mas vários estudos que se seguiu a história natural em populações têm relatado eliminação espontânea aparente.
Evidências crescentes sugerem que a H. pylori tem um papel importante na protecção de algumas doenças. A incidência de doença de refluxo ácido, Esôfago de Barrett, e câncer de esôfago têm vindo a aumentar drasticamente, ao mesmo tempo que H. presença pylori 's diminui. Em 1996, Martin J. Blaser avançada a hipótese de que o H. pylori tem um efeito benéfico: através da regulação da acidez do conteúdo do estômago. A hipótese não é universalmente aceito como vários ensaios clínicos randomizados não conseguiram demonstrar agravamento dos sintomas da doença de refluxo ácido seguintes erradicação da H. pylori. No entanto, Blaser refinou sua visão para afirmar que H. pylori é um membro da flora normal do estômago. Ele postula que as alterações na fisiologia gástrica causada pela perda de H. conta pylori para o recente aumento na incidência de várias doenças, incluindo diabetes tipo 2, obesidade, e asma . Seu grupo tem mostrado recentemente que H. colonização pylori está associada a uma menor incidência de asma na infância.
A sobrevivência do H. pylori depende de transformação e reparação do ADN recombinational
A patogênese da H. pylori depende da sua capacidade de sobreviver no ambiente gástrico dura caracterizada pela acidez, o peristaltismo, e ataque pelos fagócitos acompanhadas por liberação de espécies reativas de oxigênio. Em particular, H. pylori induz uma resposta ao estresse oxidativo durante a colonização do hospedeiro. Esta resposta ao estresse oxidativo induz adutos de DNA oxidativo potencialmente letais e mutagênicos no H. genoma pylori.
Como revisado por Michod et al., A vulnerabilidade ao estresse oxidativo e dano oxidativo ao DNA ocorre comumente em muitos patógenos bacterianos estudadas incluindo Neisseria gonorrhoeae, Haemophilus influenzae, Streptococcus pneumoniae, Streptococcus mutans e Helicobacter pylori. Para cada um desses patógenos, sobrevivendo danos ao DNA induzidos por estresse oxidativo parece ser apoiada por transformação mediada por reparação recombinatória. Assim, a transformação e reparação recombinatória parecem contribuir para a infecção bem sucedida.
Conforme resumido na Transformação (genética), transformação (a transferência de ADN de uma célula bacteriana para outra através do meio interveniente) parece ser parte de uma adaptação para a reparação do ADN. H. pylori é naturalmente competentes para a transformação. Enquanto muitos organismos são competentes apenas sob determinadas condições ambientais, tais como a fome, a H. pylori é competente em toda crescimento logarítmica. Como apontado por Dorer et al., Todos os organismos codificar programas genéticos para a resposta a situações de estresse, incluindo aqueles que causam danos ao DNA. Em H. pylori, a recombinação homóloga é necessário para reparação de ADN rupturas dos filamentos duplos (DSBs). Os AddAB resseca complexos helicase-nuclease DSBs e cargas RecA Onto única vertente DNA (ssDNA), que, em seguida, faz a mediação troca de cadeias, levando a recombinação homóloga e reparação. A exigência de RecA mais AddAB para a colonização gástrica eficiente sugere que no estômago H. pylori é exposto a qualquer dano do ADN de cadeia dupla que tem de ser reparado ou requer algum outro evento mediado por recombinação. Em particular, a transformação natural é aumentada por danos no DNA em H. pylori, e Dorer et ai. Foi encontrada uma relação entre a resposta ao dano no DNA e incorporação de ADN em H. pylori, o que sugere que a competência naturais contribui para a persistência do H. pylori em seu hospedeiro humano e explica a retenção de competências na maioria dos isolados clínicos.
RuvC proteína é essencial para o processo de reparação recombinatória uma vez que resolve intermediários neste processo designado por junções de Holliday. H. mutantes pylori que são defeituosos em RuvC ter aumentado a sensibilidade para agentes danificadores do ADN e ao estresse oxidativo, exposição reduzida sobrevivência dentro dos macrófagos, e são incapazes de estabelecer a infecção bem sucedida em um modelo de mouse. Analogamente, a proteína RECN desempenha um papel importante na reparação de DSB em H. pylori. Uma H. pylori RECN mutante exibe uma capacidade atenuada para colonizar o estômago do rato, destacando a importância da reparação do ADN de recombinação na sobrevivência de H. pylori no seu hospedeiro.
Epidemiologia
Pelo menos metade da população mundial estão infectados pela bactéria, tornando-se a infecção mais difundida no mundo. As taxas de infecção reais variam de país para país; o mundo em desenvolvimento tem as taxas de infecção muito mais altas do que o Ocidente ( Europa Ocidental, América do Norte , Australasia), onde as taxas são estimadas em cerca de 25%. A idade em que a bactéria é adquirida parece influenciar o resultado patológico possível da infecção: pessoas infectadas com ele em tenra idade são susceptíveis de desenvolver a inflamação mais intensa que pode ser seguido por gastrite atrófica, com um subsequente risco mais elevado de úlcera gástrica, cancro gástrico ou ambos. Aquisição em idade mais avançada traz gástrica diferente muda mais propensos a levar a úlcera duodenal. As infecções são geralmente adquiridos na infância em todos os países. No entanto, a taxa de infecção de crianças em países em desenvolvimento é maior do que em nações industrializadas, provavelmente devido a más condições sanitárias. Nos países desenvolvidos é atualmente raro encontrar crianças infectadas, mas a porcentagem de pessoas infectadas aumenta com a idade, com cerca de 50% infectado para aqueles com mais de 60 anos em comparação com cerca de 10% entre 18 e 30 anos. A maior prevalência entre os idosos reflete maiores taxas de infecção quando eram crianças, em vez de infecção em idades posteriores. Nos Estados Unidos, a prevalência parece ser maior em Africano-Americano e Populações latino-americanos, provavelmente devido a fatores socioeconômicos. A menor taxa de infecção no Ocidente é em grande parte atribuída aos padrões de higiene mais elevados e uso generalizado de antibióticos. Apesar das elevadas taxas de infecção em certas áreas do mundo, a freqüência global de H. pylori está em declínio. No entanto, a resistência antibiótica está aparecendo em H. pylori; já há muitos metronidazole- e claritromicina cepas resistentes em muitas partes do mundo.
H. pylori é contagiosa, embora a via exacta da transmissão não é conhecido. Transmissão pessoa-a-pessoa, quer pela via oral-oral ou via fecal-oral, é mais provável. Consistente com estas vias de transmissão, as bactérias têm sido isolados a partir de fezes, saliva e placa dental de algumas pessoas infectadas. Os resultados sugerem que H. pylori é mais facilmente transmitido através do muco gástrico do que via saliva A transmissão ocorre principalmente dentro das famílias nos países desenvolvidos mas também podem ser adquiridos a partir da comunidade nos países em desenvolvimento. H. pylori também pode ser transmitida oralmente por meio de matéria fecal através da ingestão de água contaminada com resíduos, portanto, um ambiente higiênico poderia ajudar a diminuir o risco de H. pylori.
Evolução
Helicobacter pylori migrou para fora da África, juntamente com seu hospedeiro humano por volta de 60.000 anos atrás. Sua evolução subsequente criou sete protótipos-Europa (isolado da Europa, Oriente Médio, Índia e Irã), NE África (África do Nordeste), Africa1 (a partir de países da África Ocidental e África do Sul), Africa2 (a partir de África do Sul), Asia2 (do norte da Índia e entre isolados de Bangladesh, Tailândia e Malásia), Sahul (dos aborígines australianos e Papua Nova Guiné) e Leste da Ásia com as subpopulações E Ásia (de leste-asiáticos), maori (dos aborígines de Taiwan, melanésios e polinésios) e Amerind (nativos americanos). Os precursores destes protótipos foram nomeados ancestral Europa1, ancestral Europe2, ancestral Ásia Oriental, ancestral Africa1, ancestral Africa2 e ancestral Sahul. Esses protótipos ancestrais parecem ter se originado na África, Central e Leste da Ásia. Estirpes europeias e africanas foram introduzidos nas Américas, juntamente com sua colonização-ambos os milhares de anos atrás, e mais recentemente- o comércio de escravos.
Estados de pesquisas recentes que diversidade genética em H. pylori aumenta com a distância geográfica da África Oriental , terra natal dos humanos modernos. Usando os dados de diversidade genética, os pesquisadores criaram simulações que indicam as bactérias parecem ter se espalhado do leste da África ao redor 58.000 anos atrás. Seus resultados indicam humanos modernos já foram infectados pelo H. pylori antes de sua migração para fora da África, e manteve-se associado com hospedeiros humanos desde aquela época.
História
Helicobacter pylori foi descoberto pela primeira vez nos estômagos dos pacientes com gastrite e úlcera de estômago em 1982 por Dr. Barry Marshall eo Dr. Robin Warren de Perth, Austrália Ocidental . No momento, o pensamento convencional era que nenhuma bactéria pode viver no estômago humano, tal como o estômago produzidas grandes quantidades de ácido de uma força similar ao encontrado em um ácido bateria de carro. Marshall e Warren reescreveu os livros de texto com referência ao que provoca gastrite e úlceras gástricas. Em reconhecimento da sua descoberta, eles foram agraciados com o 2005 Prêmio Nobel de Fisiologia ou Medicina.
Anterior à pesquisa de Marshall e Warren, cientistas alemães encontraram em forma de espiral bactérias no revestimento do estômago humano em 1875, mas eles foram incapazes de que a cultura, e os resultados foram eventualmente esquecidos. O pesquisador italiano Giulio Bizzozero descrito bactérias em forma semelhante que vivem no ambiente ácido do estômago de cães, em 1893. O professor Walery Jaworski da Universidade Jagiellonian em Kraków investigado sedimentos de lavagem gástrica obtidos a partir de seres humanos em 1899. Entre algumas bactérias rod-like, ele também encontrou bactérias com uma forma espiral característica, que ele chamou de Vibrio rugula. Ele foi o primeiro a sugerir um possível papel deste organismo na patogênese de doenças gástricas. Este trabalho foi incluído no Manual de Doenças gástricas, mas teve pouco impacto, uma vez que foi escrito em polonês. Vários pequenos estudos realizados no início do século 20 demonstrou a presença de bacilos curvos no estômago de muitos pacientes com úlceras pépticas e câncer de estômago. O interesse pelas bactérias diminuiu, no entanto, quando um estudo americano publicado em 1954 não respeitou as bactérias em 1180 biópsias do estômago.
Interesse em compreender o papel das bactérias em doenças do estômago foi reacendido na década de 1970, com a visualização de bactérias no estômago de pacientes com úlcera gástrica. A bactéria também tinha sido observado em 1979, pelo patologista australiano Robin Warren, que fez mais pesquisas sobre isso com o médico australiano Barry Marshall começando em 1981. Depois de várias tentativas fracassadas de cultivo da bactéria do estômago, eles finalmente conseguiram colônias visualizando em 1982, quando eles inadvertidamente deixaram a sua Placas de Petri incubação durante 5 dias através da Páscoa fim de semana. Em seu papel original, Warren e Marshall afirmaram que muitas úlceras gástricas e gastrites eram causadas por uma infecção por esta bactéria e não por estresse ou alimentos picantes, como tinha sido assumido antes.
Embora tenha havido algum cepticismo inicialmente, dentro de alguns anos numerosos grupos de pesquisa verificou a associação de H. pylori com gastrite e, em menor medida, úlceras. Para demonstrar H. pylori causou gastrite e foi não apenas um espectador, Marshall bebeu uma taça do H. cultura pylori. Ele ficou doente com náuseas e vômitos vários dias depois. Um endoscopia 10 dias após a inoculação revelou sinais de gastrite e a presença de H. pylori. Estes resultados sugerem H. pylori era o agente etiológico da gastrite. Marshall e Warren passou a demonstrar que os antibióticos são eficazes no tratamento de muitos casos de gastrite. Em 1987, o Sydney gastroenterologista Thomas Borody inventou a primeira terapia tripla para o tratamento de úlceras duodenais. Em 1994, o National Institutes of Health (EUA) publicou um parecer afirmando duodenal mais recorrente e úlceras gástricas são causadas por H. pylori, e recomendadas antibióticos ser incluídos no regime de tratamento.
A bactéria foi inicialmente nomeada Campylobacter pyloridis, posteriormente renomeado C. pylori (sendo o pylori genitivo de piloro) para corrigir uma Erro de gramática latina. Quando 16S RNA ribossomal seqüenciamento de genes e outras pesquisas mostraram em 1989 que a bactéria não pertencia ao gênero Campylobacter, que foi colocado no seu próprio género , Helicobacter. O gênero derivado do grego antigo Helix / έλιξ "espiral" ou "coil". O epíteto específico pylori meios "do piloro ou" válvula pilórica (a abertura circular que conduz a partir do estômago para o duodeno), a partir da palavra πυλωρός grego antigo, o que significa gatekeeper.
