
Centro de reação fotossintética
Você sabia ...
Esta seleção Escolas foi originalmente escolhido pelo SOS Children para as escolas no mundo em desenvolvimento sem acesso à internet. Ele está disponível como um download intranet. SOS mães cada um cuidar de uma família de crianças apadrinhadas .
Um centro de reação fotossintética (ou centro de reação fotossintética) é um complexo de várias proteínas, pigmentos e outros co-fatores reunidos para executar as reações de conversão de energia primárias de fotossíntese . Excitações moleculares, ou originários diretamente da luz solar ou transferidos como energia de excitação via sistemas de antena decolheita, dar origem a reações de transferência de elétrons ao longo de uma série de co-fatores ligados a proteínas. Estes co-fatores são moléculas de absorção de luz (também chamado cromóforos ou pigmentos), tais como e clorofila feofitina, bem como quinonas. A energia do fotão é usado para promover um electrão para uma maior nível de energia molecular de um pigmento. O energia livre criado é então utilizado para reduzir uma cadeia de perto receptores de elétrons, que têm subsequentemente maior redox-potenciais. Estes etapas de transferência de electrões são a fase inicial de uma série de reacções de conversão de energia, resultando na produção de energia química durante a fotossíntese .
Transformar a energia luminosa em separação de carga
Centros reaccionais encontram-se presentes em todos os verdes de plantas , algas , e muitas bactérias . Embora estas espécies são separadas por milhares de milhões de anos de evolução , os centros de reação são homólogas para todas as espécies fotossintéticas. Em contraste, uma grande variedade de existem complexos decolheita entre as espécies fotossintéticas. As plantas verdes e algas têm dois tipos diferentes de centros reaccionais que são parte de maiores conhecidas como supercomplexos photosystem IP700 e fotossistema II P680. As estruturas destes supercomplexos são amplos, envolvendo múltiplos complexos decolheita. O centro de reacção encontradas em Bactérias Rhodopseudomonas está actualmente melhor compreendida, uma vez que foi o primeiro centro de reação de estrutura conhecida e tem menos cadeias polipeptídicas do que os exemplos em plantas verdes.
Um centro de reação é definida de tal forma que capta a energia de um fóton usando moléculas de pigmentos e transforma-lo em uma forma utilizável. Uma vez que a energia da luz foi absorvida directamente pelas moléculas de pigmentos, ou passado a eles pela transferência de ressonância de uma envolvente complexo decolheita, eles liberam dois elétrons em uma cadeia de transporte de elétrons.
A luz é feita de pequenos pacotes de energia chamados fótons . Se um fóton com a quantidade certa de energia atinge um elétron, que irá aumentar o elétron a uma maior nível de energia. Os elétrons são mais estáveis no seu nível mais baixo de energia, o que também é chamado de seu estado fundamental. Neste estado, o electrão é da órbita que tem a menor quantidade de energia. Os electrões em níveis de energia mais elevados pode retornar ao estado fundamental de um modo análogo a uma bola que cai para baixo de uma escadaria. Ao fazê-lo, os elétrons liberam energia. Este é o processo que é explorado por um centro de reacção fotossintética.
Quando um electrão sobe a um nível de energia mais elevado, em diminuir o potencial de redução da molécula na qual o electrão reside ocorre. Isto significa que a molécula tem uma maior tendência para a doação de electrões, a chave para a conversão da energia da luz em energia química. Em plantas verdes, a cadeia de transporte de elétrons que se segue tem muitos receptores de elétrons, incluindo feofitina, quinona, plastoquinona, citocromo bf, e ferredoxina, o que resulta na molécula reduzida NADPH. A passagem do elétron através da cadeia de transporte de elétrons também resulta no bombeamento de prótons (íons de hidrogênio) do cloroplasto de no estroma lúmen, o que resulta num gradiente de protões através da membrana tilacoide que pode ser usado para sintetizar ATP através ATP sintase. Tanto o ATP e NADPH são utilizados na Ciclo de Calvin para fixar o dióxido de carbono em açúcares Triose.
Bactérias
Estrutura
| Bacteriana centro de reação fotossintética | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Bacteriana centro de reação fotossintética | |||||||||
| Identificadores | |||||||||
| Símbolo | |||||||||
| Pfam | PF00124 | ||||||||
| InterPro | IPR000484 | ||||||||
| PROSITE | PDOC00217 | ||||||||
| SCOP | 1prc | ||||||||
| SUPERFAMÍLIA | 1prc | ||||||||
| TCDB | 3.e.2 | ||||||||
| |||||||||
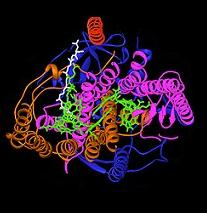
O centro de reacção fotossintética bacteriana tem sido um modelo importante para compreender a estrutura e a química do processo biológico de captar a energia da luz. Na década de 1960, Roderick Clayton foi o primeiro a purificar o complexo do centro de reação a partir de bactérias roxas. No entanto, a primeira estrutura cristalina foi determinada em 1982 por Hartmut Michel, Johann e Deisenhofer Robert Huber para que eles compartilharam o Prêmio Nobel em 1988. Este também foi significativo, uma vez que foi a primeira estrutura para todo o complexo de proteína de membrana.
Quatro subunidades diferentes foram encontrados como sendo importantes para a função do centro de reacção fotossintética. As subunidades L e M, mostrado em azul e roxo na imagem da estrutura, tanto abrangem o bicamada lipídica da membrana plasmática. Eles são estruturalmente semelhantes uns aos outros, tendo ambos 5 transmembranar hélices alfa. Quatro bacterioclorofila b (BChl-b), duas moléculas b moléculas bacteriophaeophytin (BPH), duas moléculas quinonas (Q A e B Q), e um ião ferroso são associados com o L e M subunidades. A subunidade H, mostrado em ouro, fica do lado citoplasmático da membrana plasmática. Uma subunidade do citocromo, aqui não representado, contém quatro haems do tipo C e está localizado na superfície periplasmático (exterior) da membrana. O último sub-unidade não é um motivo estrutural geral em bactérias fotossintéticas. As L e M subunidades ligar os co-fatores funcionais e interagindo de luz, mostrado aqui no verde.
Centros de reação de diferentes espécies bacterianas podem conter ligeiramente alterada bacterio-clorofila e cromóforos bacterio-feofitina como co-fatores funcionais. Estas alterações causam mudanças na cor da luz que pode ser absorvida, criando assim nichos específicos para a fotossíntese. O centro de reação contém dois pigmentos que servem para coletar e transferir a energia de absorção de fótons: BChl e HBP. BChl grosseiramente se assemelha a molécula de clorofila encontrada nas plantas verdes, mas, devido a diferenças estruturais mínimas, o seu comprimento de onda de absorção de pico é deslocada para dentro do de infravermelhos, com comprimentos de onda desde que 1000 nm. BPH tem a mesma estrutura que BChl, mas o ião magnésio central é substituído por dois protões. Esta alteração faz com que tanto um deslocamento máximo de absorvância e um potencial redox reduzido.
Mecanismo
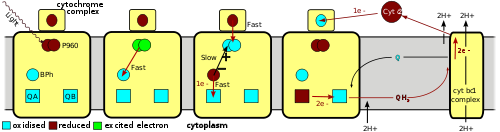
O processo inicia-se quando a luz é absorvida por duas moléculas de Bchl (a dímero) que se encontram perto da lado periplasmático da membrana. Este par de moléculas de clorofila, frequentemente chamado de "par especial", absorve fotões entre 870 nm e 960 nm, dependendo das espécies e, assim, é chamado P870 (para as espécies Rhodobacter sphaeroides) ou P960 (por Rhodopseudomonas viridis), com P permanente para "pigmento"). Uma vez que P absorve um fotão, que ejecta um electrão, o qual é transferido através de uma outra molécula de Bchl para o de BPH na subunidade G. Este inicial cobrar separação origina uma carga positiva em P e uma carga negativa na hiperplasia prostática benigna. Esse processo ocorre em 10 picossegundos (10 -11 segundos).
Os encargos relativos a specialpair + eo BPh - pode sofrer recombinação de carga neste estado. Isto iria desperdiçar a electrões de alta energia e converter a energia da luz absorvida no calor . Vários fatores da estrutura de centro de reação servir para evitar isso. Em primeiro lugar, a transferência de um elétron de BPh - para P960 + é relativamente lento comparado a outros dois reacções redox no centro da reacção. As reações mais rápidas envolvem a transferência de um elétron de BPh - (BPH - é oxidado a BPH) para o receptor de elétrons quinona (Q A), bem como a transferência de um elétron para P960 + (P960 + é reduzido a P960) a partir de um heme na subunidade citocromo acima do centro de reacção.
O electrões de alta energia que reside na molécula quinona firmemente ligado Q A é transferida para uma quinona permutável molécula Q B. Esta molécula é vagamente associado com a proteína e é bastante fácil de retirar. Dois dos electrões de alta energia são necessários para reduzir totalmente Q B para QH 2, tendo-se dois protões a partir do citoplasma do processo. A reduzida QH quinona 2 difunde através da membrana para o outro complexo de proteína ( bc citocromo um complexo n), onde é oxidado. No processo, o poder redutor do QH 2 é usado para bombear protões através da membrana para o espaço periplasmático. Os electrões do citocromo bc um complexo n são então transferidos através de um citocromo c solúvel intermediário, denominado citocromo c 2, no periplasma para a subunidade do citocromo. Assim, o fluxo de electrões neste sistema é cíclico.
As plantas verdes
Fotossíntese aeróbica
Em 1772, o químico Joseph Priestley realizada uma série de experiências relacionadas com os gases envolvidos na respiração e combustão. Em sua primeira experiência, ele acendeu uma vela e colocou-o sob um frasco arrebitado. Após um curto período de tempo, a vela queimado. Ele realizou uma experiência semelhante com um rato no espaço confinado da vela queima. Ele descobriu que o rato morreu pouco tempo depois de a vela havia sido extinta. No entanto, ele poderia reavivar o ar viciado, colocando plantas verdes na área e expô-los à luz. As observações de Priestley foram algumas das primeiras experiências que demonstram a actividade de um centro de reacção fotossintética.
Em 1779, Jan Ingenhousz realizados mais de 500 experimentos espalhados ao longo de 4 meses, em uma tentativa de entender o que estava realmente acontecendo. Ele escreveu-se suas descobertas em um livro intitulado Experiências sobre vegetais. Ingenhousz tomou as plantas verdes e imerso em água dentro de um tanque transparente. Observou muitas bolhas levantam-se da superfície das folhas quando as plantas foram expostas à luz. Ingenhousz recolheu o gás que foi emitida pelas plantas e realizou vários testes diferentes na tentativa de determinar o que o gás era. O teste revelou que, finalmente, a identidade do gás foi a colocação de um cone latente na amostra de gás e tê-lo reacender. Este teste provou que era de oxigênio, ou, como Joseph Priestley tinha chamado ele, "de- ar phlogisticated '.
Em 1932, o professor Robert Emerson e um estudante de graduação, William Arnold, usou uma técnica de flash repetitivo para medir com precisão pequenas quantidades de oxigénio evoluído pela clorofila na Chlorella algas. Sua experiência provou a existência de uma unidade fotossintética. Gaffron e Wohl mais tarde interpretou a experiência e percebi que a luz absorvida pela unidade fotossintética foi transferido. Esta reacção ocorre no centro da reacção do fotossistema II e ocorre em cianobactérias, algas e plantas verdes.
Fotossistema II
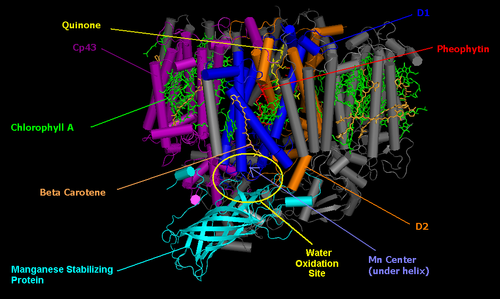
Fotossistema II é o fotossistema que gera os dois elétrons que acabará por reduzir NADP + em Ferredoxina-NADP-reduktase. Fotossistema II está presente nas membranas tilacóides dentro cloroplastos, o site da fotossíntese em plantas verdes. A estrutura do fotossistema II é muito semelhante ao centro de reacção bacteriana, e teoriza-se que eles têm um ancestral comum.
O núcleo do fotossistema II consiste duas subunidades referidas como D1 e D2. Estas duas subunidades são semelhantes ao G e M subunidades presentes no centro de reacção bacteriana. Fotossistema II difere do centro de reacção bacteriana em que ele tem muitas subunidades adicionais que se ligam clorofilas adicionais para aumentar a eficiência. A reacção global catalisada por fotossistema II é:
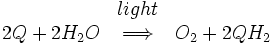
Q representa plastoquinona, a forma oxidada da P. QH 2 representa plastoquinol, a forma reduzida de P. Este processo de redução de quinona é comparável à que ocorre no centro de reacção bacteriana. Fotossistema II obtém electrões por água oxidante num processo denominado fotólise. O oxigénio molecular é um subproduto do presente processo, e é este que fornece a reacção atmosfera com oxigênio. O fato de que o oxigênio a partir de plantas verdes originado de água foi deduzido pela primeira vez pelo bioquímico americano nascido no Canadá Martin David Kamen. Ele usou um natural, isótopos estáveis de oxigênio, O 18 de rastrear o caminho do oxigênio, da água para oxigênio molecular gasoso. Esta reacção é catalisada por um centro reactivo no fotossistema II contendo quatro manganês iões .
A reacção inicia-se com a excitação de um par de moléculas de clorofila semelhantes aos descritos no centro de reacção bacteriana. Devido à presença de clorofila a, em oposição a bacterioclorofila, fotossistema II absorve a luz a um comprimento de onda mais curto. O par de moléculas de clorofila no centro de reacção são frequentemente referidos como P680. Quando o fotão foi absorvido, o electrões de alta energia resultante é transferido a uma molécula de feofitina nas proximidades. Esta está acima e para a direita do par no diagrama e é de cor cinzenta. O elétron viaja a partir da molécula de feofitina através de duas moléculas plastoquinona, o primeiro fortemente ligada, a segunda fracamente ligada. A molécula fortemente ligada é mostrada acima da molécula feofitina e é de cor vermelha. A molécula é fracamente ligado ao lado esquerdo desta e também uma coloração vermelha. Este fluxo de electrões é semelhante à do centro de reacção bacteriana. Dois electrões são necessários para reduzir totalmente a molécula plastoquinona fracamente ligada ao QH 2, bem como a absorção de dois protões.
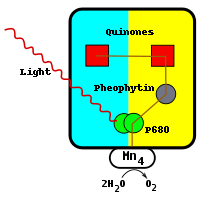
A diferença entre o fotossistema II e o centro de reacção bacteriana é a fonte de electrões que neutraliza o par de moléculas de clorofila a. No centro de reacção bacteriana, o electrão é obtido a partir de um reduzido grupo heme composto numa subunidade do citocromo ou a partir de um citocromo-c a proteína solúvel em água.
Uma vez separação de carga fotoinduzida tenha ocorrido, a molécula P680 carrega um positivo carga . P680 é um muito forte oxidantes e extratos elétrons de dois água moléculas que estão vinculados no centro de manganês diretamente abaixo do par. Este centro, em baixo e à esquerda do par no diagrama, contém quatro iões de manganês, uma cálcio , um ião cloreto , e um ião resíduo de tirosina. O manganês é eficaz porque é capaz de existir em quatro estados de oxidação: Mn 2+, Mn 3+, Mn 4+ 5+ e Mn. O manganês também forma ligações fortes com moléculas contendo oxigénio, tais como água.
Toda vez que o P680 absorve um fóton, ele emite um elétron, ganhando uma carga positiva. Esta carga é neutralizada por meio da extracção de um electrão a partir do centro de manganês, que fica directamente por baixo dele. O processo de oxidação de duas moléculas de água requer quatro elétrons. As moléculas de água que são oxidados no centro de manganês são a fonte de electrões que reduzem as duas moléculas de Q para QH 2. Até à data, esta água de separação de centro catalítico não pode ser reproduzido por qualquer catalisador feito pelo homem.
Fotossistema I
Após o electrão deixou fotossistema II é transferida para uma b6f complexo citocromo e depois para plastocianina, um azul cobre e proteína transportadora de electrões. O complexo plastocianina carrega o elétron que vai neutralizar o par no próximo centro de reação, fotossistema I.
Tal como acontece com o fotossistema II e o centro de reacção bacteriana, um par de moléculas de clorofila inicia a separação de cargas foto-induzido. Este par é referido como P700. 700 é uma referência para o comprimento de onda em que as moléculas de clorofila absorve a luz no máximo. O P700 está situado no centro da proteína. Uma vez que a separação da carga fotoinduzida tenha sido iniciado, o electrão percorre uma via através de uma molécula de clorofila α situado directamente acima do P700, através de uma molécula de quinona situado directamente acima que, por meio de três conjuntos 4FE-4S e, finalmente, a um complexo de ferredoxina intercambiáveis. Ferredoxina é uma proteína solúvel contendo um aglomerado 2Fe-2S coordenado por quatro resíduos de cisteína. A carga positiva deixada no P700 é neutralizada pela transferência de um elétron de plastocianina. Assim, a reacção global catalisada por fotossistema I é:
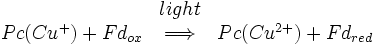
A cooperação entre fotossistemas I e II cria um fluxo de electrões a partir de H 2 O para NADP +. Esta via é chamado o 'Z-regime ", porque a diagrama redox de P680 a P700 lembra a letra z.
