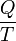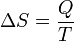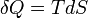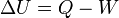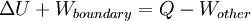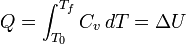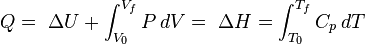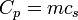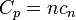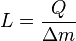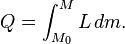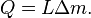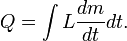Calor
Você sabia ...
Crianças SOS voluntários ajudaram a escolher artigos e fez outro material currículo Patrocinar filhos ajuda as crianças no mundo em desenvolvimento para aprender também.
Em física , o calor, simbolizado por Q, é energia transferida de um corpo ou sistema para o outro, devido a uma diferença de temperatura . Em termodinâmica , o TDS A quantidade é usada como uma medida representativa de calor, que é a temperatura absoluta de um objecto multiplicado pela quantidade diferencial de um sistema de entropia medida na limite do objecto. O calor pode fluir espontaneamente a partir de um objecto com uma temperatura elevada a um objecto com uma temperatura mais baixa. A transferência de calor a partir de um objecto para outro objecto com uma temperatura igual ou superior só pode acontecer com a ajuda de um bomba de calor. Corpos de alta temperatura, o que muitas vezes resultam em altas taxas de de transferência de calor, pode ser criado por reacções químicas (como queima), reacções nucleares (por exemplo, fusão ocorrendo dentro do Sun ), electromagnética dissipação (como em fogões elétricos), ou dissipação mecânica (tal como atrito). O calor pode ser transferido entre os objetos por radiação, condução e convecção. A temperatura é usada como uma medida da energia interna ou entalpia , que é o nível de movimento elementar dando origem a transferência de calor. Calor só pode ser transferido entre objetos ou áreas dentro de um objeto, com diferentes temperaturas (como dado pela lei zero da termodinâmica) e, em seguida, na ausência de trabalho, apenas na direcção do corpo mais frio (de acordo com a segunda lei da termodinâmica ). A temperatura e a fase de uma substância sujeita a transferência de calor são determinados pela calor latente e capacidade de calor. Um termo relacionado é energia térmica, vagamente definida como a energia de um corpo que aumenta com a sua temperatura .

Visão global
A primeira lei da termodinâmica determina que a energia de um sistema fechado é conservada. Por conseguinte, para alterar a energia de um sistema, a energia deve ser transferido para ou a partir do sistema. Calor e trabalho são os únicos dois mecanismos pelo qual a energia pode ser transferida para ou a partir de uma massa controlo. O calor é a transferência da energia causada pela diferença de temperatura. A unidade para a quantidade de energia transferida pelo calor em Sistema Internacional de Unidades SI é o Joule (J), embora o Unidade térmica britânica ea calorias ainda são ocasionalmente utilizados nos Estados Unidos. A unidade para a taxa de transferência de calor é a watt (W = J / s).
A transferência de calor é uma função path ( quantidade do processo), em oposição a um função de ponto ( quantidade estado). Fluxos de calor entre os sistemas que não estão em equilíbrio térmico com o outro; que flui espontaneamente a partir de áreas de alta temperatura para áreas de baixa temperatura. Quando dois corpos de temperatura diferente entrar em contato térmico, eles vão trocar energia interna até suas temperaturas são equalizados; isto é, até que eles atinjam o equilíbrio térmico. O adjectivo quente é utilizado como um termo relativo para comparar a temperatura do objecto a que o ambiente da (ou a da pessoa que utiliza o termo). O calor termo é usado para descrever o fluxo de energia. Na ausência de interacções de trabalho, o calor que é transferido para um objecto acaba sendo armazenado no objecto na forma de energia interna.

Calor específico é definida como a quantidade de energia que tem de ser transferida para ou a partir de uma unidade de massa ou mole de uma substância para alterar a sua temperatura por um grau. Calor específico é uma propriedade, o que significa que depende da substância em causa e seu estado como especificado por suas propriedades. Combustíveis, quando queimados, liberam grande parte da energia nas ligações químicas de suas moléculas. Após a mudança de uma fase para outra, um puro lançamentos substância ou absorve o calor sem a sua mudança de temperatura. A quantidade de transferência de calor durante uma mudança de fase é conhecido como calor latente e depende principalmente da substância e seu estado.
Energia térmica
A energia térmica é um termo muitas vezes confundido com o de calor. Genericamente falando, quando o calor é adicionado a uma sistema termodinâmico seus aumentos e de energia térmica quando o calor é retirado as suas quedas de energia térmica. Neste ponto de vista, os objetos que estão quentes são referidos como estando na posse de uma grande quantidade de energia térmica, enquanto que objetos frios possuem menos energia térmica. A energia térmica, em seguida, é muitas vezes erroneamente definida como sendo sinônimo para a palavra de calor. Isto, no entanto, não é o caso: um objecto não pode possuir calor, mas apenas energia. A energia térmica prazo quando utilizados em conversa, muitas vezes não é usado num sentido estritamente correcto, mas é mais provável de ser usado apenas como um termo descritivo. Em física e da termodinâmica, as palavras "calor", " interno da energia "," trabalho "," entalpia "(teor de calor)," entropia "," externas forças ", etc., que podem ser definidos exatamente, isto é, sem recurso a movimentos atômicos internos e vibrações, tendem a ser preferido e usado mais frequentemente do que a energia térmica prazo, o que é difícil de definir.
História
Na história da ciência , a história do calor traça suas origens a partir do primeiro hominídeos para fazer fogo e especular sobre o seu funcionamento e significado aos modernos dia físicos de partículas que estudam a natureza sub-atômica de calor. Em suma, o fenômeno do calor e sua definição evoluiu de teorias mitológicas de fogo , ao calor, à pinguis terra, phlogiston, para ar fogo, para calórico, para o teoria de calor, para o equivalente mecânico do calor, a termodinâmica (às vezes chamado energética) para termodinâmica . A história do calor, então, é um precursor para a evolução e as teorias da história da termodinâmica.
Notação
A quantidade total de energia transferida por meio de transferência de calor é convencionalmente abreviado como Q. A convenção de sinal convencional é que quando um corpo libera calor em seus arredores, Q <0 (-); . quando um corpo absorve o calor do seu entorno, Q> 0 (+) taxa de transferência de calor, ou fluxo de calor por unidade de tempo, é indicado por:
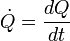 .
.
É medido em watts. fluxo de calor é definida como a taxa de transferência de calor por unidade de área da secção transversal, e é denotado q, resultando em unidades de watts por metro quadrado, embora ligeiramente diferentes convenções de notação pode ser utilizado.
Entropy
Em 1854, o físico alemão Rudolf Clausius definido o segundo teorema fundamental (a segunda lei da termodinâmica ) na mecânica teoria de calor ( termodinâmica ): "se duas transformações que, sem necessidade de qualquer outra alteração permanente, podem substituir mutuamente um ao outro, ser chamado equivalente, em seguida, as gerações de a quantidade de calor Q de trabalho à temperatura de T, tem a equivalence- valor: "
Em 1865, ele chegou a definir esta relação como entropia simbolizada pela S, tal que, para um sistema fechado, estacionário:
e assim, por redução, as quantidades de calor δQ (um diferencial inexata) são definidos como quantidades de TdS (um diferencial exato):
Em outras palavras, a função entropia S facilita a quantificação e a medição de fluxo de calor através de um limite termodinâmico.
Definições
Em termos modernos, o calor é concisa definida como a energia em trânsito. O físico escocês James Clerk Maxwell , em seu clássico de 1871 Teoria Calor, foi um dos primeiros a enunciar uma definição moderna de "calor". Em suma, Maxwell delineou quatro estipulações sobre a definição de calor. Um, é "algo que pode ser transferido a partir de um corpo para outro", de acordo com a segunda lei da termodinâmica . Dois, ele pode ser falado de como uma "quantidade mensurável", e este tratado matematicamente como outras quantidades mensuráveis. Em terceiro lugar, "não pode ser tratado como uma substância"; por isso pode ser transformado em algo que não é uma substância, por exemplo, o trabalho mecânico . Por último, é "uma das formas de energia ". Similar tão moderno, definições sucintas de calor são as seguintes:
- Em um sentido termodinâmico, o calor não é considerado como sendo armazenado dentro de um corpo. Como o trabalho, ele só existe como energia em trânsito de um corpo para outro; na terminologia termodinâmica, entre um sistema e seus arredores. Quando a energia na forma de calor é adicionado a um sistema, que é armazenada na forma de calor, mas não como energia cinética e potencial dos átomos e as moléculas que constituem o sistema.
- O calor substantivo é definido apenas durante o processo de transferência de energia por condução ou radiação.
- O calor é definido como qualquer fluxo espontâneo de energia a partir de um objecto para outro, causada por uma diferença de temperatura entre dois objectos.
- O calor pode ser definida como a energia em trânsito de um objecto de elevada temperatura para uma temperatura mais baixa do objecto.
- O calor é uma interação entre dois sistemas fechados sem troca de trabalho é uma interação de calor puro quando os dois sistemas, inicialmente isolada e em um equilíbrio estável, são colocados em contato. A energia trocada entre os dois sistemas é então chamado de calor.
- O calor é uma forma de energia possuída por uma substância em virtude do movimento vibratório, ou seja, a energia cinética, dos seus átomos ou moléculas.
- O calor é a transferência de energia entre substâncias de diferentes temperaturas.
Termodinâmica
Energia interna
O calor é relacionada com a energia interna  do sistema e trabalho
do sistema e trabalho 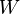 feito pelo sistema pela primeira lei da termodinâmica :
feito pelo sistema pela primeira lei da termodinâmica :
o que significa que a energia do sistema pode alterar quer através de trabalho ou por meio de fluxos de calor entre o limite do sistema termodinâmico. Em mais detalhe, A energia interna é a soma de todas as formas microscópicas de energia de um sistema. Ela está relacionada com a estrutura molecular e o grau de actividade molecular e pode ser visto como a soma da energia cinética e potencial das moléculas; que compreende os seguintes tipos de energia:
| Tipo | Composição de Interno da Energia (U) |
|---|---|
| Energia Sensible | a porção do energia interna de um sistema associado com energias cinéticas (tradução molecular, rotação e vibração; tradução de elétrons e de spin e spin nuclear) das moléculas. |
| Energia latente | a energia interna associada com a fase de um sistema. |
| Energia química | a energia interna associada com as ligações atômicas em uma molécula. |
| Energia nuclear | a enorme quantidade de energia associada ao ligações fortes dentro do núcleo do próprio átomo. |
| Interações de energia | esses tipos de energias não armazenados no sistema (por exemplo, transferência de calor, transferência de massa, e trabalho), mas que são reconhecidos no limite do sistema à medida que atravessá-la, o que representa ganhos ou perdas por um sistema durante um processo. |
| Energia térmica | a soma das formas sensível e latente de energia interna. |
A transferência de calor para um gás ideal, a pressão constante, aumenta a energia interna e executa o trabalho de contorno (ou seja, permite que um volume de gás de controlo para tornar-se maiores ou menores), desde que o volume não é limitado. Voltando à primeira lei equação e separando o termo trabalho em dois tipos, "trabalho limite" e "outros" (por exemplo, trabalho realizado por um eixo de ventilador compressor), produz o seguinte:
Esta quantidade combinada 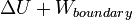 é entalpia ,
é entalpia ,  , Um dos potenciais termodinâmicos. Ambos entalpia,
, Um dos potenciais termodinâmicos. Ambos entalpia,  E energia interna,
E energia interna,  são funções do Estado. Funções do Estado voltam aos seus valores iniciais após a conclusão de cada ciclo em processos cíclicos tais como a de um motor térmico. Em contraste, nem
são funções do Estado. Funções do Estado voltam aos seus valores iniciais após a conclusão de cada ciclo em processos cíclicos tais como a de um motor térmico. Em contraste, nem  nem
nem 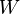 são as propriedades de um sistema e não é necessário somar a zero ao longo dos passos de um ciclo. A expressão infinitesimal de calor,
são as propriedades de um sistema e não é necessário somar a zero ao longo dos passos de um ciclo. A expressão infinitesimal de calor, 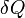 , Constitui diferencial inexata para processos que envolvam o trabalho. No entanto, por processos que não envolvam a mudança de volume, o campo magnético aplicado, ou outros parâmetros externos,
, Constitui diferencial inexata para processos que envolvam o trabalho. No entanto, por processos que não envolvam a mudança de volume, o campo magnético aplicado, ou outros parâmetros externos, 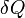 , Constitui diferencial exata. Da mesma forma, para processos adiabáticos (sem transferência de calor), a expressão para o trabalho constitui uma diferencial exata, mas para processos que envolvam transferência de calor que forma uma diferencial inexata.
, Constitui diferencial exata. Da mesma forma, para processos adiabáticos (sem transferência de calor), a expressão para o trabalho constitui uma diferencial exata, mas para processos que envolvam transferência de calor que forma uma diferencial inexata.
Capacidade de calor
Para um sistema simples compressível, tal como um gás ideal, dentro de um pistão, as alterações na entalpia da energia interna e pode ser relacionado com a capacidade calorífica a pressão constante e o volume respectivamente. constrangido a ter um volume constante, o calor, 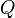 , Necessário para alterar a temperatura de uma temperatura inicial, t 0, a uma temperatura final, a T f é dada por:
, Necessário para alterar a temperatura de uma temperatura inicial, t 0, a uma temperatura final, a T f é dada por:
Removendo a restrição de volume e permitindo que o sistema para expandir ou contrair a pressão constante:
Para substâncias incompressíveis, tais como sólidos e líquidos , a distinção entre os dois tipos de capacidade de calor desaparece à medida que o trabalho é executado sem. Capacidade de calor é um grande quantidade e, como tal, é dependente do número de moléculas do sistema. Pode ser representado como o produto da massa, 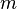 E capacidade de calor específico,
E capacidade de calor específico, 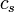 conforme:
conforme:
ou é dependente do número de moles e da capacidade térmica molar, 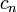 conforme:
conforme:
As capacidades caloríficas molares específicas e dependem dos graus de liberdade internos do sistema e não em quaisquer propriedades externas, tais como o volume e o número de moléculas.
Os calores específicos de gases monoatômicos (por exemplo, hélio) são quase constante com a temperatura. Diatómicas gases, tais como exibição de hidrogênio alguma dependência da temperatura e gases triatômicos (por exemplo, dióxido de carbono) ainda mais.
Em líquidos a temperaturas suficientemente baixas, se tornam significativos efeitos quânticos. Um exemplo é o comportamento de bósons, como o hélio-4. Para tais substâncias, o comportamento de capacidade de calor com a temperatura é descontínua no Bose-Einstein ponto de condensação.
O comportamento quântico de sólidos é adequadamente caracterizado pela Modelo de Debye. A temperaturas bem abaixo da temperatura de Debye característica de uma estrutura sólida, o seu calor específico irá ser proporcional ao cubo da temperatura absoluta. Para metais de baixa temperatura, um segundo termo é necessário para ter em conta o comportamento dos electrões de condução, um exemplo de Estatísticas de Fermi-Dirac.
As mudanças de fase
O ponto de ebulição da água , em do nível do mar e à pressão atmosférica normal e temperatura, sempre estará em cerca de 100 ° C, não importa o quanto de calor é adicionado. O excesso de calor altera a fase da água a partir de líquido em vapor de água . O calor adicionado para alterar a fase de uma substância deste modo é dito ser "escondido" e, portanto, é chamada calor latente (do latim significado latere "mentir escondido"). O calor latente é o calor por unidade de massa necessária para alterar o estado de uma dada substância, ou:
e
Note-se que como a pressão aumenta, o G sobe ligeiramente. Aqui, 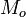 representa a quantidade de massa inicialmente na nova fase, e M é a quantidade de massa que acaba na nova fase. Além disso, a L geralmente não depende da quantidade de massa que muda de fase, pelo que a equação pode ser escrita normalmente:
representa a quantidade de massa inicialmente na nova fase, e M é a quantidade de massa que acaba na nova fase. Além disso, a L geralmente não depende da quantidade de massa que muda de fase, pelo que a equação pode ser escrita normalmente:
Às vezes, L pode ser dependente do tempo se a pressão e o volume estão mudando com o tempo, de modo que o integral pode ser escrita como:
Mecanismos de transferência de calor
O calor tende a mover-se a partir de uma região de alta temperatura para uma região de baixa temperatura. Esta transferência de calor pode ocorrer por mecanismos de condução e radiação. Em engenharia , o termo transferência de calor por convecção é usada para descrever os efeitos combinados de condução e de fluxo de fluido e é considerado como um terceiro mecanismo de transferência de calor.
Condução
A condução é o meio mais significativo de transferência de calor na forma de um sólido. Em uma escala microscópica, a condução ocorre como quente, movendo-se rapidamente ou átomos vibrando e moléculas interagem com os átomos vizinhos e moléculas, transferindo parte de sua energia (calor) para esses átomos vizinhos. Em Isoladores o fluxo de calor é realizada quase inteiramente por vibrações fônons.
O "fluido de electrões" de um metálicos condutora condutas sólidas quase todos do fluxo de calor através do sólido. Phonon fluxo está ainda presente, mas tem menos do que 1% da energia. Os elétrons também conduzir corrente eléctrica através de condutores de sólidos, e o e térmica condutividades eléctricas da maioria dos metais têm aproximadamente a mesma proporção. Um bom condutor eléctrico, tal como o cobre , geralmente também conduz o calor bem. O Efeito Peltier-Seebeck exibe a propensão de electrões para conduzir o calor através de um condutor eléctrico sólido. Termoeletricidade é causado pela relação entre elétrons, fluxos de calor e correntes elétricas.
Convecção
A convecção é geralmente a forma dominante de transferência de calor em líquidos e gases. Este é um termo utilizado para caracterizar os efeitos combinados de condução e de fluxo de fluido. Em convecção, entalpia ocorre por transferência do movimento de partes quentes ou frias do fluido, juntamente com a transferência de calor por condução. Por exemplo, quando a água é aquecida num forno, de água quente a partir do fundo do recipiente aumenta, o aquecimento da água na parte superior da panela. Dois tipos de convecção são, geralmente distinguido convecção livre, em que a gravidade e as forças de flutuação dirigir o movimento do fluido, e de convecção forçada, em que um ventilador, um agitador, ou outros meios é utilizada para mover o líquido. Convecção flutuante é devido aos efeitos da gravidade, e, portanto, não ocorre em ambientes de microgravidade.
Radiação
A radiação é a única forma de transferência de calor que pode ocorrer na ausência de qualquer tipo de meio; portanto, é o único meio de transferência de calor através de uma vácuo. A radiação térmica é uma consequência directa dos movimentos dos átomos e moléculas de um material. Uma vez que estes átomos e moléculas são compostas de partículas carregadas ( protões e electrões ), os seus movimentos resultar na emissão de radiação electromagnética , que carrega a energia para fora da superfície. Ao mesmo tempo, a superfície é constantemente bombardeada por radiação a partir do ambiente, resultando na transferência de energia para a superfície. Uma vez que a quantidade de radiação emitida aumenta com o aumento da temperatura, uma transferência líquida de energia a partir de temperaturas mais elevadas para temperaturas mais baixas resultados
O poder que um corpo negro emite em várias frequências são descritos por A lei de Planck. Há um f max frequência à qual a energia emitida é, no máximo. A lei do deslocamento de Wien, e o facto de a frequência da luz é inversamente proporcional ao seu comprimento de onda no vácuo, significa que a frequência de pico F max é proporcional à temperatura absoluta T do corpo negro. A fotosfera do Sol, a uma temperatura de aproximadamente 6000 K, emite radiação principalmente na parte visível do espectro. A atmosfera da Terra é parcialmente transparente à luz visível, ea luz que atinge a superfície da Terra é absorvida ou refletida. A superfície da Terra emite a radiação absorvida, aproximando-se do comportamento de um corpo negro a 300 K com pico espectral em f máx. A estas frequências mais baixas, a atmosfera é, em grande parte opaca e radiação da superfície da Terra é absorvida ou espalhada pela atmosfera. Embora alguma radiação escapa para o espaço, ele é absorvido e subsequentemente re-emitida pelos gases atmosféricos. É esta selectividade espectral da atmosfera, que é responsável pela planetária efeito de estufa
O agregado familiar comum ampola tem um espectro de sobreposição do espectro de corpo negro do sol e da terra. Uma parcela dos fótons emitidos por um filamento de tungstênio lâmpada em 3000K estão no espectro visível. No entanto, a maior parte da energia está associada com fótons de comprimentos de onda mais longos; estes não irá ajudar uma pessoa ver, mas ainda irá transferir calor para o ambiente, como se pode deduzir, empiricamente, observando uma lâmpada incandescente doméstica. Sempre que é emitida radiação EM e, em seguida, absorvido, o calor é transferido. Este princípio é utilizado em fornos de microondas, corte a laser, e Depilação a RF.
Outros mecanismos de transferência de calor
- Latente de calor: Transferência de calor através de uma mudança física no meio, como água-gelo ou água-vapor envolve significativo de energia e é explorada de várias maneiras: motor de vapor , geladeira etc (ver calor latente de fusão)
- Tubos de calor: Usando calor latente e capilaridade para mover o calor, tubos de calor pode levar muitas vezes tanto calor como uma haste de cobre de tamanho similar. Originalmente inventado para uso em satélites, eles estão começando a ter aplicações em computadores pessoais .
A dissipação de calor
Em climas frios, casas com seus sistemas de aquecimento formar sistemas dissipativos. Apesar dos esforços para isolar tais casas para reduzir as perdas de calor para seus exteriores, calor considerável está perdido, ou dissipada, a partir deles, que pode fazer seus interiores desconfortavelmente fresco ou frio. Para o conforto dos seus habitantes, o interior de uma casa deve ser mantida fora do equilíbrio térmico com o seu entorno externos. Com efeito, residências domésticas são oásis de calor em um mar de frio e o gradiente térmico entre o interior eo exterior muitas vezes é bastante íngreme. Isto pode levar a problemas, tais como condensação e correntes de ar desconfortáveis (rascunhos), que, se não for tratado, pode causar danos estruturais no imóvel. É por isso que as técnicas de isolamento modernos são necessárias para reduzir a perda de calor.
Em tal casa, uma termostato é um dispositivo capaz de iniciar o sistema de aquecimento quando o interior da casa cai abaixo de uma temperatura conjunto, e de parar esse mesmo sistema quando um outro (mais alto) a temperatura definida foi alcançada. Assim, o termostato controla o fluxo de energia para dentro da casa, que a energia acabou sendo dissipado para o exterior.