
Termodinâmica
Você sabia ...
Crianças SOS, que corre cerca de 200 sos escolas no mundo em desenvolvimento, organizado esta selecção. Crianças SOS é a maior doação de caridade do mundo órfãos e crianças abandonadas a chance da vida familiar.
Termodinâmica (do grego θερμη, therme, que significa " calor "e δυναμις, dunamis, que significa" poder ") é um ramo da física e é usado extensivamente na química . termodinâmica estuda os efeitos das mudanças na temperatura , de pressão e de volume na sistemas físicos no escala macroscópica, analisando o movimento coletivo de suas partículas usando estatísticas . Grosso modo, o calor significa "energia em trânsito" e refere-se a dinâmica "movimento"; assim, em essência termodinâmica estuda o movimento da energia e como a energia instila movimento. Historicamente, termodinâmica desenvolvido por necessidade de aumentar a a eficiência das primeiras máquinas a vapor .
O ponto de partida para a maioria das considerações termodinâmicas são o leis da termodinâmica, que postulam que a energia podem ser trocados entre sistemas físicos como calor ou trabalho . Eles também postulam a existência de uma quantidade chamada entropia , que pode ser definida para qualquer sistema. Em termodinâmica, as interações entre grandes conjuntos de objetos são estudadas e categorizadas. Central a esta são os conceitos de e sistema arredores. Um sistema é constituído por partículas, cujos movimentos média definir as suas propriedades, as quais por sua vez estão ligadas uma à outra através equações de estado. As propriedades podem ser combinadas para expressar interno da energia e potenciais termodinâmicos, que são úteis para a determinação de condições equilíbrio e processos espontâneos.
Com essas ferramentas, termodinâmica descreve como os sistemas respondem às mudanças em seus arredores. Isto pode ser aplicado a uma grande variedade de tópicos em ciência e engenharia , tais como motores, transições de fase, reacções químicas , fenômenos de transporte, e até mesmo buracos negros . Os resultados da termodinâmica são essenciais para outros campos da física e de química , engenharia química, engenharia aeroespacial, engenharia mecânica , biologia celular, engenharia biomédica, ciência de materiais e economia , para citar alguns.
História

A história da termodinâmica como disciplina científica geralmente começa com Otto von Guericke, que em 1650, projetou e construiu o primeiro do mundo bomba de vácuo e criou a primeira vez no mundo vácuo (conhecido como o Hemisférios de Magdeburgo). Guericke foi levado a fazer um vácuo, a fim de refutar Aristóteles 'suposição de longa data s que "a natureza abomina o vácuo". Pouco depois Guericke, o físico irlandês e químico Robert Boyle tinha aprendido de modelos de Guericke e em 1656, em coordenação com o cientista Inglês Robert Hooke, construído uma bomba de ar. Usando esta bomba, Boyle e Hooke notou uma correlação entre a pressão, temperatura e volume. Com o tempo, A lei de Boyle foi formulada, que afirma que a pressão eo volume são inversamente proporcionais. Então, em 1679, com base nesses conceitos, um associado de Boyle do chamado Denis Papin construiu uma digestor óssea, que foi um recipiente fechado com uma tampa hermética que limita a vapor até uma alta pressão foi gerado.
Projetos posteriores implementou uma válvula de liberação de vapor que manteve a máquina de explodir. Ao assistir a válvula ritmicamente mover para cima e para baixo, Papin concebeu a idéia de um pistão e um motor de cilindro. Ele não fez, no entanto, acompanhar, através de seu design. No entanto, em 1697, com base em modelos de Papin, engenheiro Thomas Savery construiu o primeiro motor. Embora estes motores adiantados eram bruto e ineficiente, que atraiu a atenção dos principais cientistas da época. Um desses cientistas era Sadi Carnot, o "pai da termodinâmica", que em 1824 publicou Reflexões sobre o Motive Power of Fire, um discurso sobre o calor, potência e eficiência do motor. O jornal delineou as relações energéticas básicas entre o Máquina de Carnot, o Ciclo de Carnot, e Força motriz. Isto marca o início da termodinâmica como uma ciência moderna.
A termodinâmica termo foi cunhado por James Joule em 1858 para designar a ciência das relações entre calor e poder. Em 1849, "termodinâmica", como um termo funcional, foi utilizado em Papel de William Thomson Uma conta de Teoria da Força Motriz de calor de Carnot. O primeiro livro termodinâmico foi escrita em 1859 por William Rankine, originalmente treinado como um físico e professor de engenharia civil e mecânica na Universidade de Glasgow.
As leis da termodinâmica
Em termodinâmica, existem quatro leis de validade muito geral, e como tal, eles não dependem os detalhes das interações ou os sistemas que estão sendo estudados. Assim, eles podem ser aplicados a sistemas sobre os quais se sabe nada mais do que o saldo de energia e matéria de transferência. Exemplos disso incluem Einstein previsão de 's emissão espontânea por volta da virada do século 20 e da pesquisa atual para a termodinâmica dos buracos negros .
As quatro leis são:
- Lei zero da termodinâmica, afirmando que equilíbrio termodinâmico é uma relação de equivalência .
- Se dois sistemas termodinâmicos são separadamente em equilíbrio térmico com um terceiro, eles também estão em equilíbrio térmico com o outro.
- Primeira lei da termodinâmica , sobre a conservação de energia
- Segunda lei da termodinâmica , a cerca de entropia
- A entropia total de qualquer sistema termodinâmico isolado tende a aumentar ao longo do tempo, aproximando-se um valor máximo.
- A terceira lei da termodinâmica , a cerca de zero absoluto de temperatura
- Como um sistema assintoticamente aproxima do zero absoluto de temperatura praticamente todos os processos e cessar a entropia do sistema assintoticamente aproxima de um valor mínimo; Também como indicado: "a entropia de todos os sistemas e de todos os estados de um sistema é zero a zero absoluto" ou de modo equivalente "é impossível alcançar o zero absoluto de temperatura por qualquer número finito de processos".
- Onsager relações recíprocas (às vezes chamado a Quarta Lei da Termodinâmica)
- Expresse a igualdade de certas relações entre fluxos e as forças em sistemas termodinâmicos fora de equilíbrio, mas onde uma noção de existe equilíbrio local.
- Veja também: Condensado de Bose-Einstein e temperatura negativa.
Potenciais termodinâmicos
Como pode ser derivado da equação de equilíbrio de energia (ou equação Burks ') sobre um sistema termodinâmico existem quantidades energéticos chamados potenciais termodinâmicos, sendo a medida quantitativa da energia armazenada no sistema. Os cinco potenciais mais conhecidos são:
| Energia interna | 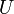 |
| Energia livre de Helmholtz | 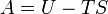 |
| Entalpia | 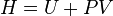 |
| Gibbs energia livre | 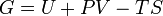 |
| Grande potencial | 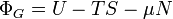 |
Outros potenciais termodinâmicos pode ser obtido através Transformação de Legendre. Potenciais são utilizadas para medir as alterações em sistemas de energia à medida que evoluem a partir de um estado inicial para um estado final. O potencial usado depende das restrições do sistema, tais como temperatura ou pressão constante. A energia interna é a energia interna do sistema, a entalpia é a energia interna do sistema, mais a energia relacionada com o trabalho de pressão-volume, e de Helmholtz e Gibbs energia são as energias disponíveis em um sistema para fazer o trabalho útil quando a temperatura e volume ou A pressão ea temperatura são fixos, respectivamente.
Termodinâmica clássica
Termodinâmica clássica é a variação de 1800 precoce original da termodinâmica em causa com os estados termodinâmicas e propriedades como a energia, trabalho e calor, e com as leis da termodinâmica, tudo falta uma interpretação atômica. Na forma precursora, termodinâmica clássica deriva químico Robert Boyle 's 1662 postulado de que a pressão P de uma dada quantidade de gás varia inversamente com o seu volume V a temperatura constante; isto é, em forma de equação: PV = k, uma constante. A partir daqui, uma aparência de um termo-ciência começou a se desenvolver com a construção das primeiras máquinas a vapor atmosférico bem sucedidos na Inglaterra por Thomas Savery em 1697 e Thomas Newcomen em 1712. A primeira e segunda leis da termodinâmica surgiu simultaneamente na década de 1850, principalmente fora das obras de William Rankine, Rudolf Clausius, e William Thomson (Lord Kelvin).
Termodinâmica estatística
Com o desenvolvimento de teorias atômicas e moleculares no final de 1800 e início de 1900, termodinâmica foi dada uma interpretação molecular. Este campo é chamado termodinâmica estatística, o que pode ser pensado como uma ponte entre as propriedades macroscópicas e microscópicas de sistemas. Essencialmente, termodinâmica estatística é uma abordagem para a termodinâmica situadas sobre mecânica estatística , que incide sobre a derivação de resultados macroscópicos de primeiros princípios. Ele pode ser contrário ao seu antecessor histórico termodinâmica fenomenológica , o que dá descrições científicas de fenômenos com a evasão de detalhes microscópicos. A abordagem estatística é derivar todas as propriedades macroscópicas (temperatura, volume, pressão, energia, entropia, etc.) a partir das propriedades de mover partículas constituintes e das interações entre eles (incluindo fenômenos quânticos). Verificou-se ser muito bem sucedida e, portanto, é geralmente utilizado.
Termodinâmica química
Termodinâmica química é o estudo da inter-relação de calor com reacções químicas ou com uma mudança física de Estado dentro dos limites do leis da termodinâmica. Durante os anos 1873-1876 o físico matemático americano Josiah Willard Gibbs publicou uma série de três artigos, sendo o mais famoso Sobre o Equilíbrio de Substâncias heterogêneas, no qual ele mostrou como processos termodinâmicos poderia ser analisados graficamente, através do estudo da energia , entropia , o volume , temperatura e pressão do sistema termodinâmico, de tal maneira para determinar se um processo iria ocorrer espontaneamente. Durante o início do século 20, os químicos, tais como Gilbert N. Lewis, Merle Randall, e EA Guggenheim começou a aplicar os métodos matemáticos de Gibbs para a análise de processos químicos.
Sistemas termodinâmicos
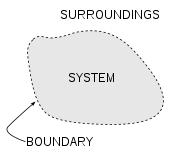
Um conceito importante em termodinâmica é o "sistema". Tudo no universo, exceto o sistema é conhecido como arredores. Um sistema é a região do universo de estudo. Um sistema é separado do restante do universo por um limite imaginário que pode ser ou não, mas que, por convenção delimita um volume finito. Os possíveis trocas de trabalho , calor , ou a matéria entre o sistema e os arredores têm lugar em todo este limite. Os limites são de quatro tipos: fixo, móvel, reais e imaginários.
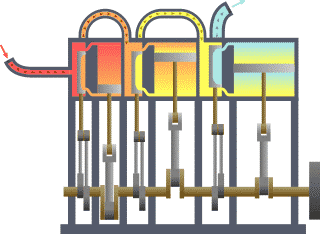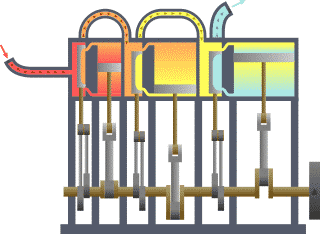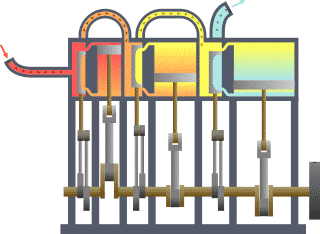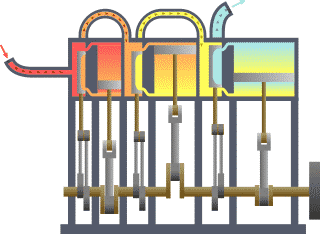
Basicamente, o "limite" é simplesmente uma linha pontilhada imaginária traçada em torno de um volume de algo quando não vai ser uma mudança na energia interna de que algo. Qualquer coisa que passa através do limite que afeta uma mudança na energia interna do que algo precisa ser contabilizados na equação do balanço de energia. Isso é algo que pode ser a região volumétrico em torno de um único átomo de ressonância energia, como Max Planck definida em 1900; ele pode ser um corpo de vapor ou ar em uma máquina a vapor , tal como Sadi Carnot definida em 1824; ele pode ser o corpo de um ciclone tropical , tal como Kerry Emanuel teorizado em 1986 no domínio da termodinâmica atmosféricas; também poderia ser apenas um nuclide (ou seja, um sistema de quarks ) como alguns estão presentemente em teorizar termodinâmica quântica.
Para um motor, um limite fixo, o pistão está bloqueado na sua posição; como tal, ocorre um processo de volume constante. Nesse mesmo motor, uma fronteira móvel permite que o pistão para entrar e sair. Para sistemas fechados, as fronteiras são reais, enquanto para o sistema aberto fronteiras são muitas vezes imaginário. Há cinco classes dominantes de sistemas:
- Sistemas Isolados - matéria e energia não podem cruzar a fronteira
- Sistemas adiabáticos - calor não deve cruzar a fronteira
- Sistemas diatérmico - calor podem cruzar fronteira
- Sistemas fechados - importa não pode cruzar a fronteira
- Sistemas Abertos - calor, trabalho e matéria pode cruzar a fronteira (muitas vezes chamado de controle de volume, neste caso)
Conforme o tempo passa em um sistema isolado, as diferenças internas no sistema tendem a nivelar e pressões e temperaturas tendem a equalizar, assim como diferenças de densidade. Um sistema no qual todos os processos de equalização foram praticamente a conclusão, é considerado para ser um em Estado de equilíbrio termodinâmico.
Em equilíbrio termodinâmico, as propriedades de um sistema são, por definição, imutável no tempo. Sistemas em equilíbrio são muito mais simples e mais fácil de compreender que os sistemas que não estão em equilíbrio. Muitas vezes, quando se analisa um processo termodinâmico, pode ser assumido que cada estado intermediário no processo está em equilíbrio. Isso também irá simplificar consideravelmente a situação. Processos termodinâmicas que se desenvolvem tão lentamente como para permitir que cada passo intermediário para ser um estado de equilíbrio são referidos como sendo processos reversíveis.
Parâmetros termodinâmicos
O conceito central da termodinâmica é a da energia , a capacidade de fazer o trabalho. Conforme estipulado pela primeira lei , a energia total do sistema e seus arredores é conservada. Pode ser transferida para um corpo de aquecimento, à compressão, ou adição de matéria, e extraiu-se a partir de um corpo ou por arrefecimento, expansão, ou extracção da matéria. Para efeitos de comparação, em mecânica, os resultados de transferência de energia de uma força que faz com que o deslocamento, o produto dos dois sendo a quantidade de energia transferida. De um modo semelhante, sistemas termodinâmicos pode ser pensada como a transferência de energia como o resultado de uma força generalizada causando um deslocamento generalizado, com o produto dos dois sendo a quantidade de energia transferida. Estes pares de força-deslocamento termodinâmicas são conhecidos como variáveis conjugado. As variáveis termodinâmicas conjugadas mais comuns são pressão-volume (parâmetros mecânicos), a temperatura-entropia (parâmetros térmicos) eo número potencial de partículas química (parâmetros do material).
Instrumentos termodinâmicos
Existem dois tipos de instrumentos termodinâmicos, o medidor e o reservatório. Um medidor termodinâmico é qualquer dispositivo que mede qualquer parâmetro de um sistema termodinâmico. Em alguns casos, o parâmetro termodinâmico é efectivamente definida em termos de um instrumento de medição idealizada. Por exemplo, a lei zero indica que, se dois corpos estão em equilíbrio térmico com um terceiro corpo, eles também estão em equilíbrio térmico com o outro. Este princípio, como observado por James Maxwell em 1872, afirma que é possível medir a temperatura. Um idealizada termómetro é uma amostra de um gás ideal a pressão constante. Do ideal PV = nRT lei dos gases, o volume de um tal exemplo pode ser utilizado como um indicador de temperatura; desta forma que define temperatura. Embora a pressão é definida mecanicamente, um dispositivo de medição de pressão, uma chamada barómetro pode também ser construído a partir de uma amostra de um gás ideal realizada a uma temperatura constante. A calorímetro é um dispositivo que é usado para medir e determinar a energia interna de um sistema.
Um reservatório termodinâmico é um sistema que é tão grande que não apreciavelmente alterar seus parâmetros de estado, quando posta em contacto com o sistema de teste. É usada para impor um valor particular de um parâmetro de estado sobre o sistema. Por exemplo, um reservatório de pressão é um sistema a uma pressão particular, que impõe que a pressão em qualquer sistema de ensaio que é ligado mecanicamente a. A atmosfera da Terra é frequentemente utilizado como um reservatório de pressão.
É importante que estes dois tipos de instrumentos são distintos. Um medidor de não cumprir a sua missão com precisão se ele se comporta como um reservatório da variável de estado que está tentando medir. Se, por exemplo, um termómetro, para actuar como um reservatório de temperatura que iria alterar a temperatura do sistema a ser medido, e a leitura seria incorrecto. Metros ideais não têm efeito sobre as variáveis de estado do sistema que eles estão medindo.
Estados termodinâmicos
Quando um sistema está em equilíbrio sob um dado conjunto de condições, diz-se estar num estado definido. O estado do sistema pode ser descrito por uma série de intensivos e variáveis variáveis extensa. As propriedades do sistema pode ser descrito por um equação de estado que especifica o relacionamento entre essas variáveis. Estado pode ser pensada como a descrição quantitativa instantânea de um sistema com um número definido de variáveis mantida constante
Processos termodinâmicos
Um processo termodinâmico pode ser definida como a evolução energético de um sistema termodinâmico Procedendo de um estado inicial para um estado final. Tipicamente, cada processo termodinâmico é distinto de outros processos, em caracteres energético, de acordo com o que os parâmetros, como temperatura, pressão, ou de volume, etc., são mantidos fixos. Além disso, é útil para agrupar estes processos em pares, em que cada variável são mantidas constantes é um membro de um par conjugado. Os sete processos termodinâmicos mais comuns são mostrados abaixo:
- Um isobárica processo ocorre a uma pressão constante.
- Um isocórico processo, ou processo isométrica / isovolumétrico, ocorre a volume constante.
- Um processo isotérmico ocorre a uma temperatura constante.
- Um processo adiabático ocorre sem perda ou ganho de calor.
- Um isentropic processo (processo adiabático reversível) ocorre a uma entropia constante.
- Um isentálpica processo ocorre a uma entalpia constante.
- A processo de estado estacionário ocorre sem uma mudança na energia interna de um sistema.
