
O iodeto de potássio
Sobre este escolas selecção Wikipedia
Arranjar uma seleção Wikipedia para as escolas no mundo em desenvolvimento sem internet foi uma iniciativa da SOS Children. SOS mães cada um cuidar de uma família de crianças apadrinhadas .
| O iodeto de potássio | |
|---|---|
 | |
 | |
O iodeto de potássio | |
Outros nomes Iodeto de Kalium, | |
| Identificadores | |
| Número CAS | 7681-11-0 |
| Número RTECS | TT2975000 |
| Propriedades | |
| Fórmula molecular | KI |
| Massa molar | 166,00 g / mol |
| Aparência | sólido cristalino branco |
| Densidade | 3,13 g / cm 3, sólido |
| Ponto de fusão | 681 ° C (954 K) |
| Ponto de ebulição | 1330 ° C (1603 K) |
| Solubilidade em água | 128 g / 100 ml (6 ° C) |
| Perigos | |
| MSDS | MSDS External |
| Frases R | R36, R38, R42 - R43, R61 |
| Frases-S | S26, S36 - S37, S39, S45 |
| Principal Perigos | Levemente prejudicial |
| NFPA 704 |  0 1 0 |
| Os compostos relacionados | |
| Outros aniões | brometo de potássio cloreto de potássio |
| Outros cátions | iodeto de lítio iodeto de sódio iodeto de rubídio iodeto de césio |
| Excepto quando indicado, os dados são dados para materiais no seu estado normal (a 25 ° C, 100 kPa) | |
| Referências de Infobox | |
O iodeto de potássio é um branco cristalino sal com fórmula química K I , usado em fotografia e tratamento de radiação. Ele encontra uma ampla aplicação como uma fonte de iodeto, porque é menos higroscópico que iodeto de sódio, tornando-o mais fácil de trabalhar. KI pode virar amarelo após aquecimento no ar ou em repouso no ar úmido por longos períodos, por causa de oxidação do iodeto a iodo .
Propriedades químicas
Iodeto de potássio comporta-se como um simples iônica sal, K + I -. Uma vez que o ião iodeto é um leve agente redutor, I - é facilmente oxidado para I 2 pela poderosa Os agentes oxidantes, tais como cloro :
Mesmo o ar irá oxidar iodeto tal como evidenciado pela observação de um extracto de roxo quando é lavado com KI diclorometano. Sob condições ácidas, KI é oxidado ainda mais facilmente, devido à formação de ácido iodídrico (HI), que é um poderoso agente de redução.
Formas KI I 3 - quando combinado com o elementar iodo .
Ao contrário do que 2, I 3 - sais pode ser altamente solúvel em água. I 2 e I 3 - têm potenciais redox virtualmente idênticos (0,535 e 0,536 V vs NHE, respectivamente), isto é são ambos oxidantes suaves em relação a H 2. Por isso, esta reacção permite que o iodo a ser utilizado em soluções aquosas para redox titulações.
O iodeto de potássio também serve em algumas reacções orgânicos como uma fonte de ião iodeto (ver "usa" abaixo).
Propriedades Físicas
Ela ocorre como cristais inodoros, incolores, transparentes ou ligeiramente opacos ou pó granulado branco. É ligeiramente higroscópico, o sabor é salina e ligeiramente amargo. Na longa exposição ao ar, torna-se amarela devido à libertação de iodo e pequenas quantidades de iodato pode ser formado.
Usos
O iodeto de potássio é utilizado em fotografia , na preparação de prata (I), iodeto de alta velocidade filme fotográfico:
Iodeto de potássio também é adicionado ao sal de mesa em pequenas quantidades para torná-lo "iodado". Em uma solução saturada, que é também utilizado como um expectorante para tratar a congestão pulmonar.
Ki é frequentemente utilizado como uma fonte de ião iodeto em síntese orgânica. Uma aplicação útil é na preparação de iodetos de arilo a partir de sais arenodiazónio. Por exemplo:
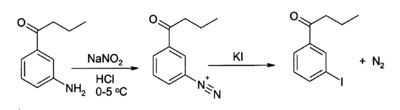
Solução saturada de iodeto de potássio é também usado como tratamento para a esporotricose, uma infecção fúngica.
Em utilização médica, que também pode servir como um anti-séptico para as pessoas que sofrem de dores de garganta. A dose é de 0,5 g, 1,0 g em 100 ml, com o acompanhante de iodo (0,5 g, 1,0 g em 100 mL).
KI também é usado como um agente de extinção de fluorescência na pesquisa biomédica por causa de extinção de colisão pelo seu ião iodeto.
Em solução aquosa com iodo elementar, que actua como um ouro decapante e vão atacar e dissolver superfícies de ouro.
Protecção contra as radiações
O iodeto de potássio pode também ser usado para proteger o tiróide de iodo radioativo em caso de um acidente ou ataque a uma usina de energia nuclear, ou outro ataque nuclear, especialmente onde uma reactor nuclear é violada e os radionuclídeos voláteis, que contêm quantidade significativa de 131 I, são liberados no meio ambiente. Radioiodine é um radionuclídeo particularmente perigoso porque o corpo concentra-lo na glândula tireóide. Iodeto de potássio não pode proteger contra outras causas de envenenamento por radiação, no entanto, nem pode proporcionar algum grau de protecção contra um bomba suja, a menos que a bomba passa a conter uma quantidade significativa de iodo radioactivo. No caso de um emergência nuclear, iodo utilizado para a limpeza de feridas não deve ser ingerido. É um veneno .

| Idade | Kl em mg | KIO 3 em mg |
|---|---|---|
| Mais de 12 anos | 130 | 170 |
| 3-12 anos de idade | 65 | 85 |
| 1-36 meses de idade | 32 | 42 |
| <1 mês de idade | 16 | 21 |
Em janeiro de 2008, John Marburger, diretor do Escritório de Política Científica e Tecnológica, nos Estados Unidos, afirmou que os comprimidos de iodeto de potássio "oferta insignificante proteção adicional" contra a exposição à radiação, e que, no caso de uma emergência de radiação nuclear, os esforços seria melhor gasto na evacuação e distribuição de alimentos seguros.
Ver produtos de fissão e os links externos para mais detalhes.
Precauções
Levemente irritante, usar luvas. Exposição crônica pode ter efeitos adversos sobre a tiróide.
