
Cloreto de sódio
Sobre este escolas selecção Wikipedia
SOS acredita que a educação dá uma chance melhor na vida de crianças no mundo em desenvolvimento também. Você quer saber sobre o patrocínio? Veja www.sponsorachild.org.uk
| Cloreto de sódio | |
|---|---|
 | |
 | |
Cloreto de sódio | |
Outros nomes Sal comum; halite; sal de mesa | |
| Identificadores | |
| Número CAS | 7647-14-5 |
| Número RTECS | VZ4725000 |
| Propriedades | |
| Fórmula molecular | Na Cl |
| Massa molar | 58,442 g / mol |
| Aparência | Cristais ou pó branco ou incolores |
| Densidade | 2,16 g / cm³, sólido |
| Ponto de fusão | 801 ° C |
| Ponto de ebulição | 1465 ° C (1.738 K) |
| Solubilidade em água | 35,9 g / 100 ml (25 ° C) |
| Estrutura | |
| Coordenação geometria | Octaédrico |
| Perigos | |
| MSDS | MSDS External |
| Frases R | 36 |
| Frases-S | nenhum |
| Principal Perigos | Picada irritante e poder |
| NFPA 704 |  0 1
0 |
| Ponto de centelha | Não inflamável |
| Os compostos relacionados | |
| Outros aniões | NaF, NaBr, Nal |
| Outros cátions | LiCl, KCl, RbCl, CsCl, MgCl2, CaCl2 |
| Relacionado sais | Acetato de sódio |
| Página Suplementar dados | |
| Estrutura e Propriedades | N, ε r, etc. |
| Termodinâmica dados | Comportamento de fase Sólido, líquido, gasoso |
| Os dados espectrais | UV, IV, RMN , MS |
| Excepto quando indicado, os dados são dados para materiais no seu estado normal (a 25 ° C, 100 kPa) | |
| Referências de Infobox | |
Cloreto de sódio, também conhecido como sal comum, sal de mesa, ou halito, é um composto químico com a fórmula de Na Cl . O cloreto de sódio é o sal mais responsável para a salinidade do oceano e do fluido extracelular de muitos multicelulares organismos . Como o ingrediente principal em sal comestível, é comumente utilizado como um condimento e comida conservante. Em um grama de cloreto de sódio, existem cerca de 0,3933 gramas de sódio, e 0,6067 gramas de cloro.
Produção e uso
O sal é actualmente produzido em massa por evaporação da água do mar ou salmoura a partir de outras fontes, tais como poços de salmoura e lagos de sal, e por sal-gema de mineração, chamado halita. Em 2002, a produção mundial foi estimada em 210 milhões de toneladas métricas, os cinco principais produtores são os Estados Unidos (40,3 milhões de toneladas), China (32,9), Alemanha (17,7), Índia (14.5), e no Canadá (12,3).
Bem como os usos conhecidos de sal em cozimento, o sal é usado em muitas aplicações, desde a fabricação de papel e celulose a definição corantes em têxteis e tecido, para produzir sabonetes e detergentes. Em países frios, as grandes quantidades de sal de rocha são usadas para ajudar a limpar estradas de gelo durante o inverno, embora "Sal de estrada" perde a sua capacidade de fusão a temperaturas inferiores a -15 ° C e -20 ° C (5 ° F a -4 ° F ). O cloreto de sódio é usado às vezes como uma barata e segura dessecante devido à sua propriedades higroscópicas, tornando salga um método eficaz de conservação de alimentos historicamente. Mesmo que dessecantes mais eficazes estão disponíveis, alguns são seguros para os seres humanos para ingerir.

Israelenses e jordanianos salinas na extremidade sul do Mar Morto

Montes de sal, Salar de Uyuni, na Bolívia .

Mina moderna sal de rocha perto Mount Morris, Nova Iorque.

Lagoas de evaporação, Aigues-Mortes, França
| Solubilidade de NaCl em vários solventes (G de NaCl / 100 g de solvente a 25 ° C) | |
|---|---|
| H2O | 26 |
| Amónia líquida | 3.02 |
| Metanol | 1.4 |
| Ácido fórmico | 5.2 |
| Sulfolane | 0,005 |
| Acetonitrilo | 0,0003 |
| Acetona | 0.000042 |
| Formamida | 9.4 |
| Dimetilformamida | 0.04 |
| Referência: Burgess, J. metal íons em solução (Ellis Horwood, Nova Iorque, 1978) ISBN 0-85312-027-7 | |
Usos sintéticos
O sal é também a matéria-prima utilizada para produzir cloro -se que é necessário para a produção de muitos materiais modernos, incluindo PVC e pesticidas. Industrialmente, o cloro elementar é normalmente produzido pela electrólise de cloreto de sódio dissolvido em água. Juntamente com cloro, este processo de cloretos alcalinos produz hidrogénio gás e hidróxido de sódio , de acordo com o equação química
- 2NaCl + 2H 2 O → Cl 2 + H2 + 2 NaOH
De metal de sódio é produzido comercialmente através da electrólise de cloreto de sódio líquido. Isto é feito de um Células de Down em que o cloreto de sódio é misturado com cloreto de cálcio para reduzir o ponto de fusão inferior a 700 ° C. Como o cálcio é mais electropositivo do que o sódio, o cálcio não será formado no cátodo. Este método é menos dispendioso do que o método anterior da electrólise de hidróxido de sódio.
O cloreto de sódio é usado em outros processos químicos para a produção em larga escala de compostos contendo cloro ou de sódio. No Processo Solvay, cloreto de sódio é usado para a produção carbonato de sódio e cloreto de cálcio . No Processo de Mannheim e na Hargreaves processo, que é utilizado para a produção de sulfato de sódio e ácido clorídrico .
Usos biológicos
Muitos microorganismos não pode viver em um ambiente excessivamente salgado: a água é retirada para fora de suas células por osmose. Por esta razão, o sal é usado para preservar alguns alimentos, tais como bacon ou peixe defumado e também pode ser utilizado para separar sanguessugas que se uniram para se alimentar. Também tem sido usado para desinfectar feridas. Em medievais vezes sal seria esfregou em superfícies domésticas como um agente de limpeza.
As funções biológicas
Nos seres humanos, a ingestão de alto teor salino foi demonstrada para atenuar a produção de óxido nítrico. O óxido nítrico (NO) contribui para a homeostase do navio através da inibição da contracção do músculo liso vascular e o crescimento, a agregação de plaquetas, adesão de leucócitos e ao endotélio [ ]
A estrutura de cristal
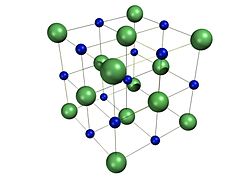
O cloreto de sódio forma de cristais cúbicos com simetria . Nestes, as maiores cloreto de iões , mostradas à direita como esferas verdes, estão dispostos em uma cúbica close-embalagem, enquanto os menores de sódio íons, mostrado à direita, como esferas azuis, preencher as lacunas octaédricos entre eles.
Cada ião é rodeada por seis iões de outro tipo. Esta mesma estrutura de base encontra-se em muitos outros minerais , e é conhecido como o estrutura halita. Este arranjo é conhecido como perto cúbico embalado (CCP). Pode ser representado como dois cúbicos (FCC) reticulados interpenetrantes de face centrada, ou uma estrutura com uma base FCC dois átomos. É mais comumente conhecido como a estrutura de cristal de sal gema.
Ela é realizada em conjunto com um ligação iônica e forças eletrostáticas .
O sal da estrada
Enquanto o sal era um bem escasso uma vez na história, a produção industrializada já fez sal abundante. Cerca de 51% da produção mundial é hoje utilizado por países frios para estradas de-gelo no inverno, tanto em escaninhos grão e propagação por veículos de serviço inverno. Isso funciona porque o sal ea água forma uma mistura eutética. A adição de sal à água irá baixar a temperatura de congelação da água, dependendo da concentração. A salinidade da água é medida como gramas de sal por quilograma (1000g) de água, e as temperaturas de congelação são como se segue.
| S (g / kg) | 0 | 10 | 20 | 24,7 | 30 | 35 |
| T (congelação) (C) | 0 | -0.5 | -1,08 | -1.33 | -1,63 | -1,91 |
Grande parte do sal da estrada usado na Europa vem de minas em Carrickfergus.
Aditivos
O sal de mesa vendidos para consumo hoje não é cloreto de sódio puro. Em 1911 carbonato de magnésio foi adicionado ao sal primeiro a fazê-lo fluir mais livremente. Em 1924 pequenas quantidades de iodo na forma de iodeto de sódio, iodeto de potássio ou iodato de potássio foram adicionados em primeiro lugar, para reduzir a incidência de simples bócio.
Sal para degelo no Reino Unido tipicamente contém sódio hexacianoferrato (II) a menos de 100 ppm como um agente anti-aglomerante. Nos últimos anos este aditivo tem também sido utilizado no sal de mesa.
Produtos químicos comuns
Os produtos químicos utilizados em sais de degelo são encontrados principalmente para ser cloreto de sódio (NaCl) ou cloreto de cálcio (CaCl2). Ambos são semelhantes e são eficazes em estradas de degelo. Quando estes produtos químicos são produzidos, eles são extraídos / feito, esmagados em grânulos finos, em seguida, tratada com um agente anti-aglomeração. A adição de sal diminui o ponto de congelação da água, o que permite que o líquido a ser estável a temperaturas mais baixas e permite que o gelo derreter. Produtos químicos de degelo alternativos também têm sido utilizados. Substâncias químicas como acetato de magnésio e cálcio formiato de potássio estão a ser produzidos. Estes produtos químicos têm alguns dos efeitos químicos negativos no ambiente comumente associado com NaCl e CaCl2.
