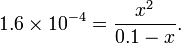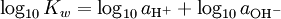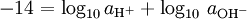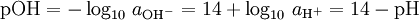pH
Informações de fundo
Crianças SOS feita esta seleção Wikipedia ao lado de outras escolas recursos . Antes de decidir sobre o patrocínio de uma criança, por que não aprender sobre as diferentes instituições de caridade de patrocínio primeiro ?
| Ácidos e Bases |
|---|
| Constante de dissociação de ácido Extração ácido-base Reacção ácido-base Acidimetria A constante de dissociação Função de acidez Soluções tampão pH Afinidade Proton A auto-ionização de água Ácido força |
| Ácido tipos |
| Brønsted · Lewis · Mineral Organic · Forte Superácidos · Fraco |
| Os tipos base |
| Brønsted · Lewis · Orgânico Forte · Superbases Não-nucleofílica · Fraco |
O pH é uma medida da acidez ou a alcalinidade de uma solução. As soluções aquosas a 25 ° C com um pH inferior a sete são considerados ácidos, enquanto que aqueles com um pH maior do que sete são considerados básico (alcalino). Quando um nível de pH é de 7,0, que é definido como "neutro" a 25 ° C, porque a este pH a concentração de H 3 O + é igual à concentração de OH - em água pura. pH é formalmente dependente da actividade de hidrónio iões (H3O +), mas para soluções muito diluídas, os molaridade de H 3 O + podem ser usadas como um substituto com pequena perda de precisão. (H + é frequentemente utilizado como sinónimo de H 3 O +.) Uma vez que o pH é dependente da actividade da iónico, uma propriedade que não pode ser medida com facilidade ou totalmente previsto teoricamente, é difícil determinar um valor preciso para o pH de uma solução . A leitura de uma solução de pH é normalmente obtida através da comparação soluções desconhecidas para aqueles de pH conhecido, e há várias maneiras de fazer isso.
O conceito de pH foi introduzido pela primeira vez por Dinamarquês químico SPL Sorensen no Carlsberg Laboratory em 1909 . O nome pH foi reivindicado ter vindo de qualquer uma das várias fontes, incluindo: pondus hydrogenii, potentia hydrogenii ( latino ), potentiel hydrogène ( Francês ), e potencial de hidrogênio ( Inglês ).
Definição
pH é definido na norma internacional ISO 31-8: operacionalmente como se segue. Para uma solução X, primeiro medir a electromotive vigor E X do célula galvânica
onde
- F é a Constante de Faraday;
- R é a constante de gás molar;
- T é a temperatura termodinâmica .
Definido desta maneira, o pH é uma quantidade adimensional. Valores de pH (S) para uma gama de soluções S padrão, juntamente com mais detalhes, são dadas na relevante Recomendação IUPAC.
pH não tem significado fundamental como uma unidade; sua definição oficial é uma prática. No entanto na gama restrita de diluído soluções aquosas tendo uma quantidade-de-dissolvido por substâncias concentrações inferiores a 0,1 mol / L, e nem sendo fortemente alcalina nem fortemente acídica (2 <pH <12), a definição é tal que
onde [H +] denota a concentração da quantidade de substância de iões de hidrogénio H + e γ 1 denota a Coeficiente de um típico actividade univalent electrólito na solução.
Explicação
Em termos mais simples, o número surge a partir de uma medida da actividade de hidrogénio iões (ou seus equivalentes) em solução. A escala de pH é uma inversa logarítmica representação de prótons de hidrogênio ( H +) concentração. Ao contrário de escalas lineares, que têm uma relação constante entre o produto a ser medido (concentração de H + no presente caso) e do valor relatado, cada unidade de pH individuais é um factor de 10 diferente do que a unidade superior ou inferior. Por exemplo, uma alteração no pH 2-3 representa uma diminuição de 10 vezes na concentração de H +, e uma mudança de 2 a 4 representa um cem (10 × 10) vezes de diminuição na concentração de H +. A fórmula para calcular pH é:
Onde α H + indica a actividade dos iões H +, e é adimensional. Nas soluções contendo outros iões, actividade e concentração não será geralmente o mesmo. A actividade é uma medida da concentração efectiva de iões de hidrogénio, em vez do que a concentração real; que inclui o fato de que outros íons que rodeiam íons de hidrogênio irá protegê-los e afectar a sua capacidade de participar de reações químicas. Estes outros iões de alterar a quantidade efectiva da concentração de iões de hidrogénio em qualquer processo que envolva H +.
Em soluções diluídas (por exemplo, água da torneira), a actividade é aproximadamente igual ao valor numérico da concentração do ião H +, denotado como [H +] (ou mais precisamente escrita, [ H3O +]), medida em moles por litro (também conhecido como molaridade). Portanto, muitas vezes é conveniente definir pH como:
Para ambas as definições, faça o login 10 denota a base 10 logaritmo , portanto, define um pH escala logarítmica de acidez. Por exemplo, se se faz um limonada com uma concentração de H + de 0,0050 moles por litro, o pH seria:
Uma solução de pH = 8,2 terá uma [H +] -8,2 concentração de 10 mol / L, ou cerca de 6,31 x 10 -9 mol / L. Assim, a sua actividade de hidrogénio α H + é de cerca de 6,31 × 10 -9. Uma solução com uma [H +] concentração de 4,5 x 10 -4 mol / L terá um valor de pH de 3,35.
Em solução, a 25 ° C, um pH de 7 indica neutralidade (isto é, o pH de água pura), porque a água dissocia-se naturalmente em H + e OH -, com concentrações iguais de 1 x 10 -7 mol / L. Um valor de pH mais baixo (por exemplo pH 3) indica a intensidade do aumento da acidez, e um valor de pH mais elevado (por exemplo pH 11) indica o aumento da força de basicidade. Note-se, no entanto, que a água pura, quando expostas à atmosfera, levará em dióxido de carbono , alguns dos quais reage com água para formar ácido carbónico e H +, diminuindo assim o pH a cerca de 5,7.
PH neutro a 25 ° C não é exactamente 7. O pH é um valor experimental, por isso, tem um erro associado. Uma vez que o constante de dissociação de água é (1,011 ± 0,005) x 10 -14, o pH da água a 25 ° C seriam 6,998 ± 0,001. O valor é consistente, contudo, com o pH neutro sendo 7,00 a dois algarismos significativos, o que é perto o suficiente para a maioria das pessoas a assumir que é exatamente 7. O pH da água fica menor com altas temperaturas. Por exemplo, a 50 ° C, o pH da água é 6,55 ± 0,01. Isto significa que uma solução diluída é neutro a 50 ° C, quando o seu pH é de cerca de 6,55 e que a um pH de 7,00 é de base.
A maioria das substâncias têm um pH no intervalo de 0 a 14, embora extremamente ácidas ou extremamente substâncias básicas podem ter pH menor que 0 ou maior que 14. Um exemplo é o escoamento de mina ácida, com pH = -3,6. Note-se que esta não se traduz a uma concentração molar de 3981 M; tais valores elevados de atividade são o resultado do extremamente elevado valor do coeficiente de atividade, enquanto as concentrações estão dentro de uma faixa de "razoável". Por exemplo, um 7,622 molar de H 2 SO 4 solução tem um pH = -3,13, actividade hidrogénio α H + por volta de 1350 e coeficiente de atividade γ H + = 165,4 quando se utiliza a convenção MacInnes para escalar Pitzer coeficiente de atividade única de iões.
Arbitrariamente, o pH é ![- \ Log_ {10} {([\ mbox {} ^ H +])}](../../images/122/12253.png) . Portanto,
. Portanto,
ou, por substituição,
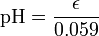 .
.
O "pH" de qualquer outra substância pode também ser encontrado (por exemplo, o potencial de iões de prata, ou pAg +) através da derivação de uma equação semelhante utilizando o mesmo processo. Estas outras equações para potenciais não serão os mesmos, no entanto, como o número de moles de electrões transferidos (n) será diferente para as diferentes reacções.
Cálculo do pH para ácidos fortes e fracos
Os valores de pH ácidos fracos e fortes pode ser aproximada usando certas teorias e suposições.
Sob a teoria de Brønsted-Lowry , ácidos fortes ou mais fracos são um conceito relativo. Mas aqui se define um ácido forte como de uma espécie que é um ácido mais forte do que o hidrónio (H3O +) de iões. Nesse caso, a reacção de dissociação (estritamente HX + H 2 O + O↔H 3 + X -, mas simplificada como HX↔H + + X -) fica completa, ou seja, sem o ácido que não reagiu permanece na solução. Dissolver o ácido forte HCl em água pode então ser expresso:
- HCl (aq) → H + + Cl -
Isto significa que, em uma solução / L 0,01 mol de HCl que é aproximada que há uma concentração de iões de hidrogénio / L dissolvidos 0,01 mol. A partir de cima, o pH é: pH = -log 10 [H +]:
- pH = -log (0,01)
que é igual a 2.
Para ácidos fracos, a reacção de dissociação não ficar completa. Um equilíbrio é alcançado entre os íons de hidrogênio e o base conjugada. O seguinte mostra a reacção de equilíbrio entre ácido methanoic e seus íons:
- HCOOH (aq) ⇌ H + HCOO + -
É necessário conhecer o valor do constante de equilíbrio da reacção para cada um ácido, a fim de calcular o seu pH. No contexto do pH, isto é denominado o constante de acidez do ácido, mas é trabalhada do mesmo modo (ver equilíbrio químico ):
- K a = [íons de hidrogênio] [íons de ácido] / [ácido]
Para HCOOH, KA = 1,6 x 10 -4
Ao calcular o pH de um ácido fraco, é geralmente assumido que a água não se fornecem quaisquer iões de hidrogénio. Isto simplifica o cálculo, e a concentração fornecida pela água, 1 x 10 -7 mol / L, é normalmente insignificante.
Com uma solução de 0,1 mol / l de ácido metanóico (HCOOH), a constante de acidez é igual a:
- K = uma [H +] [HCOO -] / [HCOOH]
Dado que uma quantidade desconhecida de ácido tenha dissociado, [HCOOH] será reduzida por este montante, enquanto [H +] e [HCOO -] cada um deles será aumentado deste montante. Portanto, [HCOOH] podem ser substituídos por 0,1 - x, e [H +] e [HCOO -] podem estar cada um substituídos por x, dando a seguinte equação:
Resolver este para x produz 3,9 × 10 -3, que é a concentração de íons de hidrogênio após dissociação. Por conseguinte, o pH é -log (3,9 x 10 -3), ou cerca de 2,4.
Medição
| Substância | pH |
|---|---|
| Ácido clorídrico , 10M | |
| Baterias de chumbo-ácido | |
| O ácido gástrico | |
| Suco de limão | |
| Cola | |
| Vinagre | |
| Laranja ou maçã suco | |
| Suco de tomate | |
| Cerveja | |
| Chuva Ácida | |
| Café | |
| Chá ou saudável pele | |
| Urina | |
| Leite | |
| Água Pura | |
| Saudável humano saliva | |
| Sangue | |
| A água do mar | |
| Sabonete | |
| Amoníaco doméstico | |
| Alvejante | |
| Lixívia doméstico |
O pH pode ser medido:
- por adição de um indicador de pH para a solução em estudo. O indicador de cor varia dependendo do pH da solução. Utilizando indicadores, as determinações qualitativas podem ser feitos com indicadores universais que têm ampla variabilidade de cor ao longo de um ampla faixa de pH e determinações quantitativas podem ser feitas por meio de indicadores que têm forte variabilidade de cor ao longo de um pequeno intervalo de pH. Medições precisas podem ser feitas através de uma ampla faixa de pH através de indicadores que têm vários equilíbrios em conjunto com métodos espectrofotométricos para determinar a abundância relativa de cada componente dependente do pH que formam a cor da solução, ou
- usando um medidor de pH com eletrodos de pH selectivo ( eléctrodo de vidro de pH, eléctrodo de hidrogénio, eletrodo quinhydrone, ion campo sensível efeito transistor e outros).
- pelo uso de papel pH, papel indicador que transforma cores correspondente a um pH em uma tecla de cor. papel de pH é geralmente pequenas tiras de papel (ou uma fita contínua que pode ser rasgada) que foi embebida em uma solução de indicador, e é utilizado para aproximações.
Os mais baixos e mais altos extremidades da escala de pH não oxidar. O meio da escala é o que se oxida, tais como água e sangue.
À medida que a escala de pH é logarítmica, não começam em zero. Assim o mais ácido de líquidos encontrados pode ter um pH tão baixo quanto -5. O mais tipicamente alcalina tem pH de 14. Medição de valores de pH extremamente baixos, têm várias complicações. A calibração do eléctrodo em tais casos, pode ser realizada com soluções padrão de ácido sulfúrico concentrado, cujos valores de pH pode ser calculado com o modelo de Pitzer.
Como um exemplo de aplicação em casa, a medição do valor de pH pode ser usado para quantificar a quantidade de ácido em uma piscina.
pOH
Há também pOH, em certo sentido o oposto do pH, que mede a concentração de iões OH -, ou o basicidade. Visto que a água auto ioniza e notating [OH -] como a concentração de hidróxido de iões, temos
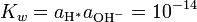 (*)
(*)
onde K é a constante de w ionização de água.
Agora, desde
por identidades logarítmicas, temos então a relação:
e assim
Esta fórmula é válida para exatamente temperatura = 298,15 K (25 ° C) apenas, mas é aceitável para a maioria dos cálculos de laboratório.
Indicadores
Um indicador é utilizado para medir o pH de uma substância. Indicadores comuns são papel decisivo, fenolftaleína, metil-laranja, vermelho de fenol, azul de bromotimol, bromocresol verde e púrpura de bromocresol. Para demonstrar o princípio com materiais domésticos comuns, repolho vermelho, que contém o corante antocianina, é usado.
A água do mar
Em medição Oceanography pH química é complicado pela propriedades químicas de água do mar , e várias escalas de pH distintos existir.
Como parte de sua definição operacional da escala de pH, o IUPAC definir uma série de soluções de tampão ao longo de uma gama de valores de pH (geralmente denotada com NBS ou Designação NIST). Estas soluções têm uma relativamente baixa força iónica (~ 0,1) comparada com a da água do mar (~ 0,7), e consequentemente não são recomendados para utilização na caracterização do pH da água do mar (uma vez que as diferenças de força iónica causar mudanças na potencial eléctrico). Para resolver este problema, uma série alternativa de tampões com base em água do mar artificial foi desenvolvido. Esta nova série resolve o problema das diferenças de força iónica entre as amostras e os tampões, e a nova escala de pH é referido como a escala total, frequentemente denotado como o pH T.
A escala total foi definida utilizando um meio contendo sulfato de íons. Esses íons experimentar protonação, H + + SO 4 2- ⇌ HSO 4 -, de modo que a escala total inclui o efeito de ambos os prótons (íons de hidrogênio "livres") e íons sulfato de hidrogênio:
- [H +] T = [H +] + F [HSO 4 -]
Uma escala alternativa, a escala livre, muitas vezes denotado pH F, omite essa consideração e se concentra exclusivamente em [H +] F, em princípio, tornando-se uma representação mais simples da concentração de íons de hidrogênio. Analiticamente, apenas [H +] T pode ser determinado, então [H +] F deve ser estimada utilizando a [SO 4 2-] ea constante de HSO 4 estabilidade -, K S *:
- [H +] F = [H +] T - [HSO 4 -] = [H +] T (1 + [SO 4 2-] / K * S) -1
No entanto, é difícil de estimar K * S em água do mar, o que limita a utilidade da escala livre de outra forma mais simples.
Outra escala, conhecida como a escala de água do mar, muitas vezes denotado SWS pH, toma conta de um outro relacionamento protona�o entre íons de hidrogênio e íons de flúor, H + + F - ⇌ HF. Resultando na seguinte expressão para [H +] SWS:
- [H +] SWS = [H +] F + [HSO 4 -] + [IC]
No entanto, a vantagem de considerar esta complexidade adicional é dependente da abundância de fluoreto do meio. Na água do mar, por exemplo, iões sulfato ocorrer em concentrações muito maiores (> 400 vezes) do que aqueles de fluoreto. Por conseguinte, para a maioria dos fins práticos, a diferença entre o total de água do mar e escalas é muito pequena.
Os três equações a seguir resumem as três escalas de pH:
- pH F = - log [H +] F
- pH T = - log ([H +] + F [HSO 4 -]) = - log [H +] T
- SWS pH = - log ([H +] + F [HSO 4 -] + [IC]) = - log [H +] SWS
Em termos práticos, as três escalas de água do mar pH diferem nos seus valores até 0,12 unidades de pH, diferenças que são muito maiores do que a precisão das medições de pH normalmente necessários (particularmente em relação à do oceano sistema de carbonato). Uma vez que omite a consideração de íons sulfato e fluoreto, a escala livre é significativamente diferente de ambos os totais de água do mar e escalas. Por causa da importância relativa do ião fluoreto, o total de água do mar e escalas diferem apenas muito ligeiramente.
Os fluidos corporais
| Fluido | pH |
|---|---|
| ácido gástrico | 0,7 |
| lisossoma | 5.5 |
| grânulo de célula cromafim | 5.5 |
| Neutro H 2 O a 37 ° C | 6,81 |
| cytosol | 7.2 |
| CSF | 7.3 |
| arterial plasma sanguíneo | 7,4 |
| matriz mitocondrial | 7,5 |
| secreções exócrinas pâncreas | 8.1 |
O pH diferente fluidos corporais varia com a função e outros factores. Na maior parte é um sistema fortemente regulada para manter a homeostase ácido-base.
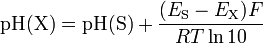
![\ Text {} pH = - \ log_ {10} \ left [\ frac {\ gamma_1 [\ text {H} ^ +])} {\ texto {1 mol L} ^ {- 1}} \ right] \ pm 0,02](../../images/122/12238.png)
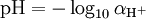
![\ Mbox {pH} \ approx - \ log_ {10} {\ frac {[\ mathrm {H ^ +}]} {1 ~ \ mathrm {mol / L}}}](../../images/122/12251.png)

![\ Mbox {} pH = - \ log_ {10} {[{\ mbox {} ^ H +}]}](../../images/122/12254.png)