
O cloreto de alumínio
Fundo para as escolas Wikipédia
Esta seleção Escolas foi originalmente escolhido pelo SOS Children para as escolas no mundo em desenvolvimento sem acesso à internet. Ele está disponível como um download intranet. Veja http://www.soschildren.org/sponsor-a-child para saber mais sobre apadrinhamento de crianças.
| O cloreto de alumínio | |
|---|---|
 | |
 | |
De alumínio (III), cloreto de | |
Outros nomes Tricloreto de alumínio | |
| Identificadores | |
| Propriedades | |
| Fórmula molecular | AlCl3 |
| Massa molar | 133,34 g mol -1 (anidro) 241,432 g mol-1 (hexa-hidrato) |
| Aparência | Sólido amarelo pálido, higroscópico. |
| Densidade | 2,48 g cm -3 |
| Ponto de fusão | 190 ° C 463 K ) |
| Ponto de ebulição | 178 ° C (451 K) ( subi) |
| Solubilidade em água | 43,9 g / 100 ml (0 ° C) 44,9 g / 100 ml (10 ° C) 45,8 g / 100 ml (20 ° C) 46,6 g / 100 ml (30 ° C) 47,3 g / 100 ml (40 ° C) 48,1 g / 100 ml (60 ° C) 48,6 g / 100 ml (80 ° C) 49 g / 100 ml (100 ° C) |
| Estrutura | |
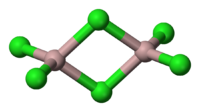
| A estrutura de cristal | 6 coordenada estrutura de camadas |
| Coordenação geometria | Octahedral (sólido) Tetrahedral (líquido) |
| Forma molecular | Planar Trigonal ( vapor monomérica) |
| Perigos | |
| MSDS | MSDS External |
| Classificação da UE | Corrosivo (C) |
| Frases R | R34 |
| Frases-S | (S1 / 2), S7 / 8, S28, S45 |
| Os compostos relacionados | |
| Outros aniões | O fluoreto de alumínio Brometo de alumínio Iodeto de alumínio |
| Outros cátions | Tricloreto de boro Gálio (III) cloreto de Índio (III), cloreto de De tálio (III), cloreto de O cloreto de magnésio |
| Relacionado Ácidos de Lewis | Ferro (III) Cloreto Trifluoreto de boro |
| Página Suplementar dados | |
| Estrutura e Propriedades | N, ε r, etc. |
| Termodinâmica dados | Comportamento de fase Sólido, líquido, gasoso |
| Os dados espectrais | UV, IV, RMN , MS |
| Excepto quando indicado, os dados são dados para materiais no seu estado normal (a 25 ° C, 100 kPa) | |
| Referências de Infobox | |
O cloreto de alumínio (AICI3) é um composto de alumínio e cloro . O sólido tem um baixo ponto de fusão e ponto de ebulição, e é ligado de forma covalente. Ele sublima a 178 ° C . Molten AlCl3 conduz eletricidade mal, ao contrário mais iônico halogenetos, tais como cloreto de sódio . Existe no estado sólido como uma rede de seis coordenadas camada.
AlCl3 adota a estrutura "ycl 3", com Al 3+ cúbico estrutura em camadas perto lotado. Em contraste, AlBr 3 tem uma estrutura molecular mais, com os centros de Al 3+ ocupando buracos tetraédricos adjacentes do quadro repleto de perto de Br - íons. Após a fusão dá o AlCl3 dímero Al 2 Cl 6, que pode vaporizar. Em mais elevadas temperaturas este Al 2 Cl 6 dímero dissocia-se em plano trigonal AlCl 3, que é estruturalmente análogo ao BF 3.
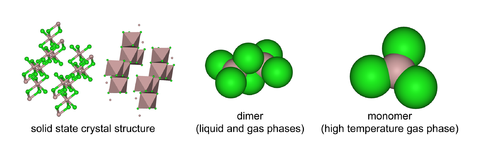
O cloreto de alumínio é altamente deliquescent, e pode explodir ao entrar em contato abrupto com água por causa do alto calor de hidratação. Aquosas soluções de AICI3 são iónico e assim conduzir eletricidade bem. Tais soluções são encontrados para ser acídica , indicativo de parcial hidrólise do Al 3+. As reacções podem ser descritas (simplificado) como:
- [Al (H 2 O) 6] 3 + + H2O ⇌ [Al (OH) (H2O) 5] 2+ + H 3 O +
AICI3 é provavelmente a mais utilizada Ácido de Lewis e também um dos mais poderosos. Ele encontra uma ampla aplicação na indústria química como o clássico catalisador para Friedel-Crafts reações, tanto acilações e alquilações. Ele também encontra utilização em e polimerização reacções de isomerização de hidrocarbonetos. Alumínio também forma uma menor cloreto de alumínio (I), cloreto de (AlCl), mas isso é muito instável e conhecido apenas na fase de vapor.
Propriedades químicas
O cloreto de alumínio é um poderoso Ácido de Lewis, capaz de formar adutos estáveis Lewis ácido-base, mesmo com fraca Bases de Lewis, tais como benzofenona ou mesitileno. Não é de surpreender que forma AlCl 4 -, na presença de íons cloreto.
Na água, formas hidrólise parcial O gás de HCl ou H 3 O +, tal como descrito na síntese acima. As soluções aquosas um comportamento semelhante ao outro alumínio sais contendo Al 3+ hidratados íons , dando um gelatinoso precipitado de hidróxido de alumínio mediante reacção com a quantidade correcta de solução aquosa de hidróxido de sódio :
AlCl3 ( aq) + 3 NaOH (aq) → Al (OH) 3 ( s ) + 3 NaCl (aq)
Preparação
O cloreto de alumínio é fabricado em grande escala pela reacção exotérmica de metal de alumínio com cloro ou cloreto de hidrogénio.
- 2 Al + 3 Cl2 → 2 AlCl3
- 2 Al + 6 HCl → 2 AlCl 3 + 3 H 2
As formas hidratadas são preparados por dissolução de óxidos de alumínio com ácido clorídrico.
Usos
O Reacção de Friedel-Crafts é o principal uso de cloreto de alumínio, por exemplo, na preparação de antraquinona (para o indústria de corantes) a partir de benzeno e fosgénio. No geral Reacção Friedel-Crafts, um cloreto de acilo ou haleto de alquilo reage com um sistema aromático como mostrado:
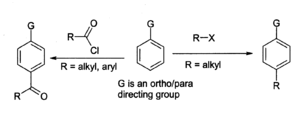
Com benzeno derivados , o produto principal é a Pará isômero. A reacção de alquilação tem muitos problemas associados, tais como em Friedel-Crafts, por isso é menos usado do que a reacção de acilação. Para ambas as reacções, o cloreto de alumínio, bem como outros materiais e o equipamento, deve ser moderadamente seco, embora um traço de humidade é necessária para que a reacção prossiga. Um problema geral com a reacção de Friedel-Crafts é que o cloreto de "alumínio catalisador "tem de estar presente na sua totalidade quantidades estequiométricas em ordem para a reacção fique completa, porque Complexos fortemente com os produtos (ver propriedades químicas acima). Isto torna muito difícil de reciclar, por isso, devem ser destruídos após a sua utilização, gerando uma grande quantidade de resíduos corrosivos. Por esta razão, os químicos estão a analisar a utilização de mais catalisadores ambientalmente benignas como itérbio (III) ou triflato de disprósio (III), triflato, o qual pode ser reciclado .
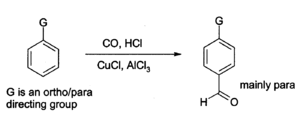
O cloreto de alumínio também pode ser utilizada para introduzir grupos aldeído Onto anéis aromáticos, por exemplo, através da Reacção de Gatterman-Koch, que utiliza o monóxido de carbono , de cloreto de hidrogénio e um de cobre (I), cloreto de co- catalisador ):
O cloreto de alumínio encontra uma grande variedade de outras aplicações em química orgânica . Por exemplo, pode catalisar a " reacção eno ", tal como a adição de 3-buten-2-ona (metil-vinil-cetona) para carvone:
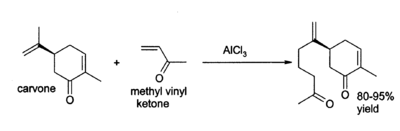
AlCl3 também é amplamente utilizada para e polimerização reacções de isomerização de hidrocarbonetos. Exemplos importantes incluem a fabricação de etilbenzeno, que costumava fazer estireno e, assim, poliestireno , e também a produção de dodecilbenzeno, o qual é usado para fazer detergentes.
O cloreto de alumínio combinado com alumínio na presença de um areno pode ser utilizado para sintetizar bis (areno) complexos de metais, por exemplo, bis (benzeno) crómio, a partir de certos halogenetos de metais por meio do chamado- Fischer-Hafner síntese.
O cloreto de alumínio, muitas vezes sob a forma de derivados tais como cloridrato de alumínio, é um componente comum no antitranspirantes em baixas concentrações. Sofrem de hiperidrose precisam de uma concentração muito mais elevada (15% ou superior), vendido sob marcas como Drysol®, Maxim®, ODABAN®, CertainDri®, B + e Drier® Driclor®.
Precauções
AICI3 anidro reage vigorosamente com água e bases, de modo precauções adequadas são necessários. Sais hidratados são menos problemáticos.
