Tetracloreto de carbono
Você sabia ...
Crianças SOS têm produzido uma seleção de artigos da Wikipedia para escolas desde 2005. Crianças SOS tem cuidado de crianças em África há 40 anos. Você pode ajudar o seu trabalho na África ?
| Tetracloreto de carbono | |
|---|---|
 |  |
Tetracloreto de carbono | |
Outros nomes Benziform, cloreto de carbono, metano tetracloreto, perchlorométhane, Carbon tet, Benzinoform, Tetraform, Tetrasol, Freon 10, Halon 104, da ONU 1846 | |
| Identificadores | |
| Número CAS | 56-23-5 |
| PubChem | 5943 |
| Número da CE | 200-262-8 |
| KEGG | C07561 |
| Chebi | Chebi: 27385 |
| Número RTECS | FG4900000 |
| Imagens-jmol 3D | Imagem 1 |
SMILES
| |
InChI
| |
| Propriedades | |
| Fórmula molecular | CCl4 |
| Massa molar | 153,82 g / mol |
| Aparência | Líquido incolor |
| Densidade | 1,5842 g / cm 3, líquida 1,831 g.cm -3 a -186 ° C (sólido) |
| Ponto de fusão | -22,92 ° C (250 K) |
| Ponto de ebulição | 76,72 ° C (350 K) |
| Solubilidade em água | 0,8 g / L a 25 ° C |
| log P | 2.64 |
| Pressão de vapor | 11,94 kPa a 20 ° C |
| k H | 365 kJ.mol -1 a 24,8 ° C |
| Estrutura | |
| A estrutura de cristal | Monoclinic |
| Forma molecular | Tetrahedral |
| Perigos | |
| MSDS | MSDS External |
| Classificação da UE | Tóxicos (T), Carc. Gato. 2B, Perigoso para o ambiente (N) |
| Frases R | R23 / 24/25, R40, R48 / 23, R59, R52 / 53 |
| Frases-S | (S1 / 2), S23, S36 / 37, S45, S59, S61 |
| NFPA 704 |  0 3 0 |
| Ponto de centelha | Não inflamável |
| Página Suplementar dados | |
| Estrutura e Propriedades | N, ε r, etc. |
| Termodinâmica dados | Comportamento de fase Sólido, líquido, gasoso |
| Os dados espectrais | UV, IV, RMN , MS |
| Excepto quando indicado, os dados são dados para materiais no seu estado normal (a 25 ° C, 100 kPa) | |
| Referências de Infobox | |
O tetracloreto de carbono, também conhecida por vários outros nomes (ver Tabela) é o composto químico com a fórmula CCl4. É um em reagente química sintética e era anteriormente utilizado em extintores de incêndio e como um precursor para refrigerantes. É um líquido incolor com um cheiro "doce" que podem ser detectados em níveis baixos.
Ambos tetracloreto de carbono e tetraclorometano são nomes aceitáveis sob nomenclatura IUPAC . Coloquialmente, é chamado de "tet de carbono".
História e síntese
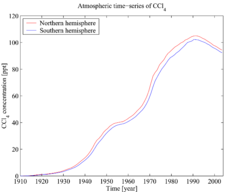
A produção de tetracloreto de carbono tenha diminuído acentuadamente desde a década de 1980 devido a preocupações ambientais e com a redução da demanda por Os CFC, que foram derivados a partir de tetracloreto de carbono. Em 1992, a produção em os EUA-Europa-Japão foi estimada em 720 milhões kg.
O tetracloreto de carbono foi originalmente sintetizada em 1839 por reacção de clorofórmio com cloro, a partir do químico francês Henri Victor Regnault, mas agora é sintetizada principalmente de metano:
- CH 4 + 4 Cl 2 → CCl 4 + 4 HCl
A produção muitas vezes utiliza subprodutos de outro reacções de cloração, tais como as sínteses de e diclorometano clorofórmio. Chlorocarbons mais elevados também são submetidos a "chlorinolysis:"
- C 2 Cl Cl 2 + 6 2 → CCl4
Antes de 1950, o tetracloreto de carbono foi fabricado pela cloração de dissulfureto de carbono a 105 a 130 ° C:
- CS 2 + 3 Cl2 + → CCl4 S 2 Cl 2
Propriedades
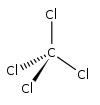
No tetracloreto de carbono molécula , quatro cloro átomos estão posicionadas simetricamente como cantos em um tetraédrico configuração associados a um carbono átomo, no centro, por uma única ligações covalentes. Devido à sua geometria simétrica, a molécula não tem qualquer líquido momento dipolar; isto é, CCI4 é não polar. Como solvente , é bem adequado para a dissolução de outros compostos não polares, gorduras e óleos. Ele é um pouco voláteis, emitindo vapores com um odor característico de outros solventes clorados, um pouco semelhante à tetracloroetileno cheiro que lembra lojas de limpeza a seco.
Tetrachloromethane sólido tem dois alótropos : crystaline II abaixo -47,5 ° C (225,6 K) e cristalina I acima -47,5 ° C.
Na -47,3 ° C, tem estrutura cristalina monoclínica com grupo espacial C2 / c e treliça constantes a = 20,3, b = 11,6, C = 19,9 (0,10 nm) -1, β = 111 °.
Usos
No início do século 20, tetracloreto de carbono foi amplamente utilizado como um limpeza a seco solvente , como um refrigerante, e em extintores de incêndio. No entanto, uma vez que se tornou evidente que a exposição tetracloreto de carbono tiveram efeitos adversos para a saúde graves, alternativas mais seguras, como tetracloroetileno foram encontrados para estas aplicações, e seu uso nestes papéis diminuiu de cerca de 1940 em diante. Tetracloreto de carbono persistido como um pesticida para matar insetos em grãos armazenados, mas em 1970 , ele foi proibido em produtos de consumo no Estados Unidos .
Antes da Protocolo de Montreal, grandes quantidades de tetracloreto de carbono foram utilizados para produzir o freon refrigerantes R-11 ( triclorofluorometano) e R-12 ( diclorodifluorometano). No entanto, esses fluidos refrigerantes são agora acreditado para desempenhar um papel na destruição do ozônio e foram eliminados. Tetracloreto de carbono ainda é usado para a fabricação de refrigerantes menos destrutivas.
O tetracloreto de carbono foi também usado na detecção de neutrinos. Tetracloreto de carbono é um dos mais potentes hepatotoxinas, e é largamente utilizado em pesquisas científicas para avaliar agentes hepatoprotectores 7,8
Reatividade
Tetracloreto de carbono não tem praticamente nenhuma inflamabilidade a temperaturas mais baixas. Sob temperaturas elevadas no ar, forma-se venenosos fosgénio.
Porque ele não tem ligações CH, tetracloreto de carbono não é fácil sofrer reacções de radicais livres. Por isso, é um solvente útil para halogenações quer pela halogéneo elementar, ou por um reagente de halogenação tal como N-bromo-succinimida.
Em química orgânica , tetracloreto de carbono serve como uma fonte de cloro na Reação Appel.
Solvente
Ele é utilizado como um solvente na pesquisa química sintética, mas devido aos seus efeitos adversos para a saúde, não é mais comummente usado, e os químicos em geral, tentar substituí-lo com outros solventes. Por vezes, é útil como um solvente para espectroscopia de infravermelho, porque não há bandas de absorção significativas> 1.600 centímetros -1. Tetracloreto de carbono, porque não tem quaisquer átomos de hidrogénio, que foi historicamente utilizada em protões espectroscopia de RMN . No entanto, o tetracloreto de carbono é tóxico, e o seu poder de dissolução é baixo. Seu uso tem sido em grande parte substituída por solventes deuterados, que oferecem propriedades solvatantes superior e permitem bloqueio de deutério pelo espectrômetro.
Segurança
A exposição a elevadas concentrações de tetracloreto de carbono (incluindo de vapor) podem afectar a sistema nervoso central, degenerar o fígado e os rins e pode resultar (após exposição prolongada) em coma e até morte . A exposição crônica ao tetracloreto de carbono pode causar e fígado danos nos rins e pode resultar em cancro Mais informação pode ser encontrada em Fichas de dados de segurança deste material.
Tetracloreto de carbono também é tanto esgotam o ozônio e um gás de efeito estufa . No entanto, desde 1992, as suas concentrações atmosféricas têm estado em declínio por razões descritas acima (ver também a figura de séries temporais atmosférica).