
Carbono
Informações de fundo
Crianças SOS, que corre cerca de 200 sos escolas no mundo em desenvolvimento, organizado esta selecção. Você quer saber sobre o patrocínio? Veja www.sponsorachild.org.uk
| Carbono | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
6 C | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||
claro (diamante) e preto (grafite)  Linhas espectrais de carbono | |||||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||||
| Nome, símbolo, número | de carbono, C, 6 | ||||||||||||||||||||||||||||||
| Pronúncia | / k ɑr b ən / | ||||||||||||||||||||||||||||||
| Categoria Metallic | metalóide | ||||||||||||||||||||||||||||||
| Grupo, período, bloco | 14, 2, p | ||||||||||||||||||||||||||||||
| Peso atômico padrão | 12,011 (1) | ||||||||||||||||||||||||||||||
| Configuração eletrônica | [Ele] 2s 2p 2 2 2, 4 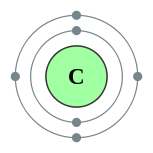 | ||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||
| Descoberta | Egípcios e sumérios (3750 aC) | ||||||||||||||||||||||||||||||
| Reconhecido como um elemento por | Antoine Lavoisier (1789) | ||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||
| Densidade (perto RT) | amorfo: 1,8-2,1 g · cm -3 | ||||||||||||||||||||||||||||||
| Densidade (perto RT) | diamante: 3,515 g · cm -3 | ||||||||||||||||||||||||||||||
| Densidade (perto RT) | grafite: 2.267 g cm -3 · | ||||||||||||||||||||||||||||||
| Ponto de sublimação | 3915 K, 3642 ° C, 6588 ° F | ||||||||||||||||||||||||||||||
| Ponto Triplo | 4600 K (4327 ° C), 10800 kPa | ||||||||||||||||||||||||||||||
| Calor de fusão | 117 (grafite) kJ mol -1 · | ||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 6,155 (diamante) 8.517 (grafite) J · · mol -1 K -1 | ||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||
| Estados de oxidação | 4, 3, 2, 1, 0, -1, -2 , -3 , -4 | ||||||||||||||||||||||||||||||
| Eletronegatividade | 2,55 (escala de Pauling) | ||||||||||||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 1086,5 kJ · mol -1 | ||||||||||||||||||||||||||||||
| 2: 2352,6 kJ · mol -1 | |||||||||||||||||||||||||||||||
| 3: 4620,5 kJ · mol -1 | |||||||||||||||||||||||||||||||
| O raio de covalência | 77 (sp³), 73 (sp²), 69 (sp) pm | ||||||||||||||||||||||||||||||
| Van der Waals raio | 170 pm | ||||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||||
| A estrutura de cristal | diamante (Diamante, claro) | ||||||||||||||||||||||||||||||
hexagonal simples  (Grafite, preto) | |||||||||||||||||||||||||||||||
| Ordenamento magnético | diamagnetic | ||||||||||||||||||||||||||||||
| Condutividade térmica | 900-2300 (diamante) 119-165 (grafite) W · m -1 · K -1 | ||||||||||||||||||||||||||||||
| Expansão térmica | (25 ° C) 0,8 (diamante) uM · · K -1 m -1 | ||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 18350 (diamante) m · s -1 | ||||||||||||||||||||||||||||||
| O módulo de Young | 1050 (diamante) GPa | ||||||||||||||||||||||||||||||
| Módulo de cisalhamento | 478 (diamante) GPa | ||||||||||||||||||||||||||||||
| Massa de módulo | 442 (diamante) GPa | ||||||||||||||||||||||||||||||
| Rácio de Poisson | 0,1 (diamante) | ||||||||||||||||||||||||||||||
| Dureza de Mohs | 10 (diamante) 1-2 (grafite) | ||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-44-0 | ||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de carbono | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
Carbono (do latim : carbo "carvão") é o elemento químico com o símbolo C e número atômico 6. Como membro da grupo 14 na tabela periódica , é não metálico e quatro elétrons disponíveis para formar de tomada tetravalente ligações químicas covalentes. Existem três ocorrem naturalmente isótopos , com 12 C e 13 C que é estável, enquanto 14 C é radioactivos, decaindo com uma meia-vida de cerca de 5730 anos. O carbono é um dos alguns elementos conhecidos desde a antiguidade.
Existem vários alótropos do carbono, dos quais os mais conhecidos são grafite, diamante , e carbono amorfo. O propriedades físicas do carbono variam muito com a forma alotrópica. Por exemplo, o diamante é altamente transparente, enquanto que a grafite é opaco e preto. O diamante é um dos materiais mais duros conhecidos, enquanto grafite é suave o suficiente para formar uma raia em papel (daí o seu nome, da palavra grega "escrever"). O diamante tem uma muito baixa condutividade elétrica, enquanto grafite é um muito bom condutor. Sob condições normais, diamante, nanotubos de carbono e grafeno têm a maior condutividades térmicas de todos os materiais conhecidos.
Todas as formas alotrópicas de carbono são sólidos sob condições normais com grafite, sendo o mais forma termodinamicamente estáveis. Eles são resistentes quimicamente e exigem temperaturas elevadas para reagir ainda com oxigénio. O mais comum estado de oxidação do carbono em compostos inorgânicos é 4, enquanto que 2 é encontrado em monóxido de carbono e de outros metais de transição complexos de carbonilo. As maiores fontes de carbono inorgânico são calcários, Dolomitas e dióxido de carbono , mas quantidades significativas ocorrem em depósitos orgânicos de carvão , turfa, óleo e clatratos de metano. O carbono forma mais compostos do que qualquer outro elemento, com quase dez milhões de puros compostos orgânicos descritos até à data, que por sua vez são uma pequena fração desses compostos que são teoricamente possível em condições normais.
O carbono é o 15º elemento mais abundante na crosta da Terra, ea quarto elemento mais abundante no universo em massa depois de hidrogênio , hélio e oxigênio . Ela está presente em todas as formas de vida conhecidas, e no carbono corpo humano é o segundo elemento mais abundante por massa (cerca de 18,5%) depois de oxigénio. Esta abundância, juntamente com a diversidade única de compostos orgânicos e a sua capacidade de formação de polímero invulgar às temperaturas comummente encontradas em Terra , tornam este elemento a base química de toda a vida conhecida.
Características
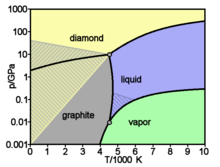
As diferentes formas ou alótropos de carbono (ver abaixo) incluem o que ocorre naturalmente mais difícil substância, diamante , e também uma das substâncias mais suave conhecidos, grafite. Além disso, ele tem uma afinidade para ligação com outros pequenos átomos , incluindo outros átomos de carbono, e é capaz de formar estável múltipla ligações covalentes com tais átomos. Como resultado, o carbono é conhecido por formar quase dez milhões de compostos diferentes; a grande maioria de todos os compostos químicos . Carbono também tem a maior de sublimação de todos os elementos. Em pressão atmosférica não tem ponto de fusão como o seu ponto triplo é de 10,8 ± 0,2 MPa e 4,600 ± 300 K (~ 4330 ° C ou 7820 ° F), para que ele sublima a cerca de 3.900 K.
Sublima de carbono em um arco de carbono que tem uma temperatura de cerca de 5800 K (5530 ° C; 9.980 ° F). Assim, independentemente da sua forma alotrópica, carbono permanece sólido a temperaturas mais elevadas do que as mais elevadas de metais tais como o ponto de fusão de tungsténio ou o rénio . Embora termodinamicamente propenso a oxidação, a oxidação do carbono resiste mais eficazmente do que elementos, tais como ferro e cobre que são agentes redutores fracos, à temperatura ambiente.
Compostos de carbono formam a base de toda a vida conhecida na Terra , ea ciclo carbono-nitrogênio fornece parte da energia produzida pelo Sol e outras estrelas. Embora ela forma uma variedade extraordinária de compostos, a maioria das formas de carbono são relativamente não reactiva nas condições normais. À temperatura e pressão normal, mas que resiste a todos os oxidantes mais fortes. Ele não reage com o ácido sulfúrico , ácido clorídrico , cloro ou quaisquer substâncias alcalinas. A temperaturas elevadas de carbono reage com o oxigénio para formar óxidos de carbono, e irá reduzir óxidos de metal tais como óxido de ferro para o metal. Este reacção exotérmica é usado na indústria de ferro e aço para controlar o teor de carbono de aço:
- Fe 3 O 4 + 4 C (S) → 3 Fe (s) + 4 CO (g)
com enxofre para formar dissulfureto de carbono e com vapor de água na reacção de gás de carvão:
- C (s) + H2O (g) → CO (g) + H2O (g).
Carbono combina-se com alguns metais a temperaturas elevadas para formar carbonetos metálicos, tais como o carboneto de ferro cementite em aço, e carboneto de tungsténio, amplamente utilizado como um abrasivo e dicas para fazer duros para ferramentas de corte.
A partir de 2009, grafeno parece ser o material mais forte já testado. No entanto, o processo de separação de que grafite irá requerer algum desenvolvimento tecnológico, antes que seja económico suficiente para ser usado em processos industriais.
O sistema de alótropos de carbono abrange uma gama de extremos:
| Sintético nanocristalino diamante é o material mais duro conhecido. | A grafite é um dos materiais mais suaves conhecidas. |
| O diamante é o melhor abrasivo. | Grafite é um muito bom lubrificante, exibindo superlubricity. |
| O diamante é um excelente eléctricos isolante. | A grafite é um condutor de eletricidade. |
| O diamante é o mais conhecido que ocorre naturalmente condutor térmico | Algumas formas de grafite são utilizados para isolamento térmico (ou seja, corta-fogos e escudos de calor) |
| O diamante é altamente transparente. | Grafite é opaco. |
| Diamante cristaliza no sistema cúbico. | Grafite cristaliza no sistema hexagonal. |
| De carbono amorfo é completamente isotrópico. | Os nanotubos de carbono estão entre os mais materiais anisotrópicos já produziu. |
Allotropes
Atomic carbono é uma espécie muito curta duração e, portanto, o carbono é estabilizado em várias estruturas multi-atômicas com configurações moleculares diferentes chamados allotropes . Os três allotropes relativamente bem conhecidas de carbono são carbono amorfo, grafite e diamante . Uma vez considerado exótico, fulerenos são hoje comumente sintetizada e utilizada na pesquisa; eles incluem buckyballs, nanotubos de carbono, nanobuds carbono e nanofibras. Várias outras formas alotrópicas exóticas também foram descobertos, tal como Lonsdaleite, de carbono vítreo, nanofoam carbono e carbono acetilénico linear (carbino).
O forma amorfa é uma variedade de átomos de carbono de uma forma não-cristalina, irregular, estado vítreo, que é essencialmente grafite, mas não realizada em uma macroestrutura cristalina. Ele está presente como um pó, e é o principal constituinte de substâncias tais como carvão, lampblack ( fuligem) e carvão activado. A pressões normais de carbono assume a forma de grafite, em que cada átomo está ligado a outros três trigonally num plano composto por fundidos hexagonais anéis, assim como aqueles em hidrocarbonetos aromáticos. A rede resultante é 2-dimensional, e as folhas planas resultantes são empilhados e frouxamente ligado através fraco forças de van der Waals . Isto dá grafite sua suavidade e sua propriedades de clivagem (as folhas escorregar facilmente passado um outro). Por causa da deslocalização de um dos electrões exteriores de cada átomo, para formar um π-cloud, grafite conduz eletricidade , mas apenas no plano de cada ligado covalentemente folha. Isto resulta numa massa inferior condutividade elétrica para o carbono do que para a maioria dos metais . A deslocalização também é responsável pela estabilidade energética de grafite sobre o diamante à temperatura ambiente.
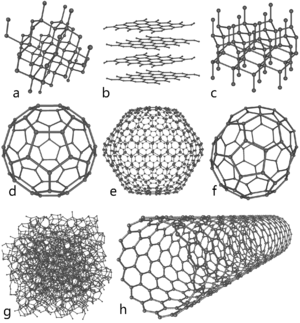
A pressões muito elevadas de carbono forma o allotrope mais compacta de diamante , que tem quase duas vezes a densidade de grafite. Aqui, cada átomo está ligado tetraedricamente a quatro outros, tornando assim uma rede 3-dimensional da franzidos anéis de seis membros de átomos. O diamante tem a mesma estrutura cúbica como silício e germânio e, devido à força das carbono-carbono ligações , é a substância que ocorre naturalmente mais difícil em termos de resistência ao risco . Contrariamente à crença popular de que " os diamantes são para sempre ", eles são de fato termodinamicamente instável em condições normais e se transformar em grafite. No entanto, devido a uma barreira de energia de activação elevada, a transição para a grafite é de modo extremamente lento à temperatura ambiente, que é indetectável. Sob algumas condições, como carbono cristaliza Lonsdaleite. Esta forma tem um hexagonal cristal treliça, onde todos os átomos estão ligados de forma covalente. Portanto, todas as propriedades de Lonsdaleite são próximos aos do diamante.
Fulerenos tem uma estrutura de grafite semelhante, mas em vez de meramente empacotamento hexagonal, que também contêm pentágonos (ou mesmo heptágonos) de átomos de carbono, que dobra a folha em esferas, elipses ou cilindros. As propriedades dos fulerenos (dividido em buckyballs, buckytubes e nanobuds) ainda não foram totalmente analisados e representam uma área de intensa pesquisa em nanomateriais. Os nomes "fulereno" e "buckyball" são proferidas após Richard Buckminster Fuller, divulgador da domos geodésicos, que se assemelham a estrutura dos fulerenos. As buckyballs são moléculas relativamente grandes formadas completamente de carbono ligado trigonally, formando esferóides (o mais conhecido e mais simples é o em forma de bola de futebol C 60 buckminsterfullerene). Os nanotubos de carbono são estruturalmente semelhantes aos fulerenos, excepto que cada átomo está ligado trigonally numa folha curva que se forma uma cavidade cilindro. Nanobuds foram relatadas pela primeira vez em 2007 e são materiais de tubo / fulerenos Bucky híbridos (fulerenos são covalentemente ligados à parede externa de um nanotubo) que combinam as propriedades de ambos numa única estrutura.
Dos outros allotropes descobertos, nanofoam carbono é um alótropo ferromagnético descobertos em 1997. Ele é constituído por um aglomerado de baixa densidade-conjunto de átomos de carbono encadeadas em uma teia tridimensional solta, na qual os átomos estão ligados trigonally em anéis de seis e sete membros. Está entre os sólidos mais leve conhecidos, com uma densidade de cerca de 2 kg / m 3. Da mesma forma, de carbono vítreo contém uma elevada proporção de fechado porosidade, mas ao contrário do grafite normal, as camadas de grafite não estão empilhadas como páginas de um livro, mas tem um arranjo mais aleatória. Linear carbono acetilénico tem a estrutura química - (C ::: C) n -. De carbono desta modificação é linear com sp hibridação orbital, e é um polímero com a alternância de ligações simples e triplos. Este tipo de carbyne é de considerável interesse para nanotecnologia como o seu O módulo de Young é de quarenta vezes maior do que o material mais duro conhecido - diamante.
Ocorrência


O carbono é o quarto elemento químico mais abundante no universo em massa depois de hidrogênio, hélio e oxigênio. O carbono é abundante nas Sun , estrelas , cometas , e no atmosferas da maioria dos planetas . Alguns meteoritos contêm diamantes microscópicos que se formaram quando o sistema solar era ainda um disco protoplanetário. Diamantes microscópicas também podem ser formadas pela pressão intensa e alta temperatura nos locais de impactos de meteoritos.
Em combinação com o oxigênio em dióxido de carbono , o carbono é encontrado na atmosfera da Terra (aproximadamente 810 gigatoneladas de carbono) e dissolvidos em todos os corpos de água (cerca de 36 mil gigatoneladas de carbono). Cerca de 1.900 gigatoneladas de carbono estão presentes na biosfera . Hidrocarbonetos (como carvão , petróleo e gás natural ) contêm carbono como bem carvão "reservas" (e não "recursos") ascendem a cerca de 900 gigatoneladas, e reservas de petróleo ao redor de 150 gigatoneladas. Fontes comprovadas de gás natural são cerca de 175 10 12 metros cúbicos (que representam cerca de 105 gigatoneladas de carbono), mas estima-se que há também cerca de 900 10 12 metros cúbicos de gás "não convencional", como o gás de xisto, representando cerca de 540 gigatoneladas de carbono. (No passado, as quantidades de hidrocarbonetos foram maiores. No período 1751-2008 cerca de 347 gigatoneladas de carbono foram lançadas como o dióxido de carbono para a atmosfera pela queima de combustíveis fósseis.) De carbono também está preso como metano e hidratos de metano nas regiões polares. Estima-se que, pelo menos, 1400 Gt de carbono é sob esta forma apenas no (ou menos) do submarino permifrost do Plataforma Siberiana.
O carbono é um componente importante em grandes massas de carbonato de rocha ( calcário, dolomita, mármore e assim por diante). O carvão é a maior fonte comercial de carbono mineral, respondendo por 4.000 gigatoneladas ou 80% do combustível de carbono fóssil. Também é rica em carbono - por exemplo, antracite contém 92-98%.
Quanto a formas alotrópicas de carbono individuais, da grafite é encontrado em grandes quantidades no Estados Unidos (principalmente em Nova York e Texas), Rússia , México , Groenlândia , e Índia . Os diamantes naturais ocorrem na rocha kimberlito, encontrado em antigos vulcânicas "gargalos", ou "canos". A maioria dos depósitos de diamantes estão em África , nomeadamente na África do Sul , Namíbia , Botswana , a República do Congo , e Serra Leoa . Existem também depósitos em Arkansas, Canadá , o russo Arctic , Brasil e no norte e ocidental Austrália . Os diamantes são agora também a ser recuperados do fundo do oceano ao largo da Cabo da Boa Esperança. No entanto, embora os diamantes são encontrados naturalmente, cerca de 30% de todos os diamantes industriais utilizados em os EUA agora são feitos sinteticamente.
É formado de carbono-14 nas camadas superiores da troposfera e estratosfera, em altitudes de 9-15 km, por uma reacção que é precipitado pela raios cósmicos. Neutrões térmicos são produzidos que colidem com os núcleos de azoto, formando-14 de carbono-14 e um protão.
Isótopos
Os isótopos de carbono são os núcleos atómicos que contêm seis protões além de um número de neutrões (variando de 2 a 16). O carbono tem dois estáveis, que ocorrem naturalmente isótopos . O isótopo carbono-12 (12 C) formar 98,93% do carbono na Terra, enquanto carbono-13 (13 C) constitui a 1,07% remanescente. A concentração de 12 C é aumentada em materiais biológicos porque reacções bioquímicas discriminar 13 C. Em 1961, o União Internacional de Química Pura e Aplicada (IUPAC) adotou o isótopo carbono-12 como base para a pesos atômicos. Identificação de carbono em As experiências de RMN é feito com o isótopo 13 C.
Carbono-14 (14 C) é uma ocorrência natural radioisótopo que ocorre em quantidades vestigiais na Terra de até 1 parte por trilhão (0,0000000001%), principalmente confinado aos depósitos atmosfera e superficiais, particularmente de turfa e outros materiais orgânicos. Este isótopo decai por 0,158 MeV β - emissão. Devido à sua relativamente curta meia-vida de 5730 anos, 14 C é praticamente ausente em rochas antigas, mas é criado no atmosfera superior (inferior estratosfera e superior troposfera) por interacção de azoto com raios cósmicos. A abundância de 14 C no atmosfera e nos organismos vivos é quase constante, mas diminui de maneira previsível em seus corpos após a morte. Este princípio é utilizado em datação por radiocarbono, inventado em 1949, que tem sido amplamente utilizado para determinar a idade de materiais carbonáceos com idades até cerca de 40.000 anos.
Existem 15 isótopos conhecidos de carbono eo menor duração destes é 8 C que decai através emissão de prótons e decaimento alfa e tem uma meia-vida de -21 1.98739x10 s. O exótico 19 C exibe um auréola nuclear, o que significa que a sua raio é sensivelmente maior do que seria de esperar se o núcleo era um domínio constante de densidade .
Formação em estrelas
Formação do núcleo atômico de carbono requer uma colisão tripla quase simultânea de partículas alfa ( hélio núcleos) no interior do núcleo de um gigante ou supergigante que é conhecido como o processo de tripla-alfa, como os produtos de outras reacções de fusão nuclear de hélio com hidrogénio ou outro produto núcleo de hélio lítio-5 e berílio-8, respectivamente, sendo que ambos são altamente instáveis e decadência quase instantaneamente de volta em núcleos menores. Isso acontece em condições de temperaturas mais de 100 megakelvin e hélio concentração que a rápida expansão e resfriamento do início do universo proibidas, e, portanto, nenhum carbono significativa foi criada durante o Big Bang . Em vez disso, os interiores das estrelas no ramo horizontal transformar três núcleos de hélio em carbono por meio deste processo triplo alfa. A fim de estar disponível para a formação da vida como a conhecemos, esse carbono deve, então, mais tarde, ser espalhadas no espaço, como poeira, em supernovas explosões, como parte do material que mais tarde formas segundo, sistemas estelares de terceira geração que têm planetas acrescidos de tal pó. O Sistema Solar é um tal de terceira geração sistema de estrelas. Outra das estrelas mecanismos de fusão através de alimentação é o Ciclo CNO, na qual os actos de carbono como um catalisador para permitir que a reacção prossiga.
Transições de rotação de várias formas isotópicas de monóxido de carbono (por exemplo, 12 Co, 13 Co, C e 18O) são detectáveis no submillimeter gama de comprimento de onda, e são usados no estudo de recém-formando estrelas em nuvens moleculares.
Ciclo do carbono
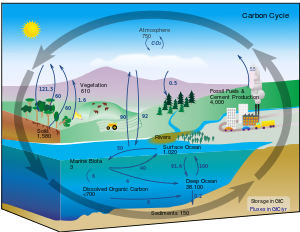
Sob condições terrestres, conversão de um elemento para outro é muito rara. Portanto, a quantidade de carbono na Terra é efetivamente constante. Assim, os processos que utilizam carbono deve obtê-lo em algum lugar e descartá-la em outro lugar. Os caminhos que segue de carbono no ambiente compõem o ciclo do carbono. Por exemplo, plantas desenhar dióxido de carbono para fora de seu ambiente e usá-lo para construir biomassa, como em respiração de carbono ou o Ciclo de Calvin, um processo de fixação de carbono. Parte dessa biomassa é comido por animais, enquanto que uma parte do carbono é exalado por animais como o dióxido de carbono. O ciclo do carbono é consideravelmente mais complicado do que este laço curto; por exemplo, algum dióxido de carbono é dissolvido nos oceanos; planta morta ou matéria animal pode tornar-se o petróleo ou o carvão , que pode queimar com a liberação de carbono, as bactérias não deve consumi-lo.
Compostos
Compostos orgânicos
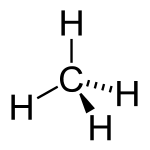
O carbono tem a capacidade de formar muito longas cadeias de interconexão de ligações CC. Esta propriedade é chamada catenation. Ligações carbono-carbono são fortes e estáveis. Esta propriedade permite-carbono para formar um número quase infinito de compostos; Na verdade, há compostos que contêm carbono mais conhecido do que todos os compostos de outros elementos químicos combinados excepto os de hidrogénio (porque quase todos os compostos orgânicos contêm também hidrogénio).
A forma mais simples de uma molécula orgânica é a hidrocarboneto de uma grande família de moléculas orgânicas que são compostas de hidrogénio átomos ligados a uma cadeia de átomos de carbono. Comprimento da cadeia, cadeias laterais e grupos funcionais todos afectar as propriedades de moléculas orgânicas. Por Definição da IUPAC, todos os outros compostos orgânicos são compostos de hidrocarbonetos funcionalizados.
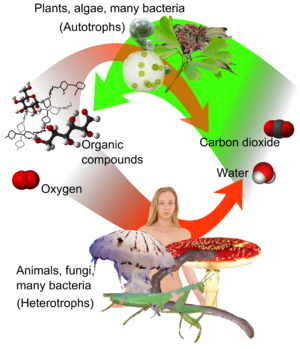
Carbono ocorre em todos conhecidos vida biológica e é a base da química orgânica . Quando unidos com hidrogênio , ele forma vária hidrocarbonetos que são importantes para a indústria como refrigerantes, lubrificantes, solventes , como matéria-prima química, para o fabrico de plásticos e petroquímicos e como os combustíveis fósseis .
Quando combinado com o oxigênio eo hidrogênio, carbono pode formar muitos grupos de compostos biológicos importantes, incluindo açúcares , lignanas, quitinas, álcoois , gorduras, e aromático ésteres, carotenóides e terpenos. Com azoto que constitui alcalóides, e com a adição de enxofre também se forma antibióticos , aminoácidos e borracha produtos. Com a adição de fósforo a estes elementos, forma-se o ADN e ARN, os portadores de código de química da vida, e de adenosina trifosfato (ATP), a molécula de transferência de energia mais importante em todas as células vivas.
Compostos inorgânicos
Comumente os compostos que estão associados com minerais ou que não contenham um átomo de hidrogénio ou de flúor, contendo carbono, são tratados separadamente clássicos compostos orgânicos ; no entanto, a definição não é rígida (ver artigos de referência acima). Entre estes são os óxidos de carbono simples. O óxido mais proeminente é dióxido de carbono (CO 2). Esse já foi o principal constituinte do paleoatmosphere, mas é um componente menor da atmosfera da Terra hoje. Dissolvido em água , forma-se ácido carbónico (H 2 CO 3), mas como a maioria dos compostos com múltiplos átomos de oxigénio individuais-aderentes, sobre um único carbono é instável. Através deste intermediário, no entanto, estabilizado com ressonância de carbonato de iões são produzidos. Alguns minerais importantes são os carbonatos, em particular calcite . Dissulfureto de carbono (CS2) é semelhante.
O outro óxido comum é o monóxido de carbono (CO). Ele é formado por combustão incompleta, e é um líquido incolor, inodoro. As moléculas de cada uma contém uma ligação tripla e são bastante polar, resultando em uma tendência para se ligarem de forma permanente a moléculas de hemoglobina, o oxigénio, que tem uma menor afinidade de ligação. O cianeto (CN -), tem uma estrutura semelhante, mas comporta-se como um ião halogeneto ( pseudo). Por exemplo, pode formar o nitreto molécula de cianogénio (CN (2)), semelhante a halogenetos diatómicas. Outros óxidos são incomuns subóxido de carbono (C 3 O 2), o instável monóxido de dicarbon (C 2 O), trióxido de carbono (CO 3), cyclopentanepentone (C 5 O 5) cyclohexanehexone (C 6 O 6), e anidrido melítico (C 12 S 9).
Com reativas metais , como o tungstênio , formas de carbono ou carbonetos (C 4-) ou acetiletos (C 2-
2) para formar ligas com pontos de fusão elevados. Estes aniões estão também associados com metano e de acetileno , ambos muito fracos ácidos . Com uma electronegatividade de 2,5, prefere carbono para formar ligações covalentes. Alguns carbonetos são reticulados covalentes, como carborundum (SiC), que se assemelha diamante .
Os compostos organometálicos
Os compostos organometálicos, por definição, contêm pelo menos uma ligação metal-carbono. Uma ampla variedade de tais compostos existem; classes principais incluem compostos alquil-metálicos simples (por exemplo, tetraetilchumbo), η 2 alceno compostos (por exemplo, Compostos η 3 -alilo de sal Zeise), e (por exemplo, dímero de cloreto de alilpaládio); metalocenos contendo ligandos de ciclopentadienilo (por exemplo, ferroceno); e complexos de metais de transição carbeno. Muitos existem carbonyls de metal (por exemplo, tetracarbonylnickel); alguns trabalhadores considerar o monóxido de carbono do ligando a ser puramente inorgânicos, e não organometálico.
Enquanto o carbono é entendido para formar quatro ligações exclusivamente, um composto muito interessante que contém um átomo de carbono octaédrica hexacoordinated foi reportado. O catião do composto é [(Ph 3 Pau) 6 C] 2+. Este fenómeno tem sido atribuída à aurophilicity dos ligandos de ouro.
História e etimologia

O Inglês nome de carbono vem do latim carbo do carvão e carvão vegetal, de onde também vem o francês charbon, o que significa carvão. Em alemão , holandês e Dinamarquês, os nomes de carbono são Kohlenstoff, koolstof e kulstof respectivamente, todos literalmente significa carvão -substância.
Carbono foi descoberto em pré-história e foi conhecido nas formas de e fuligem carvão vegetal para os primeiros humanos civilizações . Diamantes eram conhecidos provavelmente tão cedo como 2500 aC na China, enquanto de carbono sob a forma de carvão foi feito em torno tempos romanos pela mesma química como é hoje, aquecendo madeira em uma pirâmide coberta com argila para excluir o ar.

Em 1722, René Antoine Ferchault de Réaumur demonstrou que o ferro foi transformado em aço através da absorção de alguma substância, agora conhecido por ser de carbono. Em 1772, Antoine Lavoisier mostrou que os diamantes são uma forma de carbono; quando ele queimou amostras de carvão e diamante e descobriu que não produzia qualquer água e que ambos lançados a mesma quantidade de dióxido de carbono per grama. Em 1779, Carl Wilhelm Scheele mostrou que a grafite, que tinha sido pensado como uma forma de ligação , em vez disso era idêntica com carvão vegetal, mas com uma pequena mistura de ferro, e que deu "ácido aéreo" (o seu nome para o dióxido de carbono) quando oxidado com ácido nítrico ácido. Em 1786, os cientistas franceses Claude Louis Berthollet, Gaspard Monge e CA Vandermonde confirmou que o grafite era principalmente de carbono por oxidação-lo em oxigênio da mesma maneira Lavoisier tinha feito com diamante. Alguns ferro de novo foi deixado, o que os cientistas franceses pensava que era necessário para a estrutura de grafite. No entanto, em sua publicação que propôs o nome Carbone (carbonum Latina) para o elemento em grafite que foi emitida como um gás em cima de grafite ardente. Antoine Lavoisier, em seguida, listados de carbono como um elemento em seu livro de 1789.
Um novo alótropo de carbono, fulereno, que foi descoberto em 1985 inclui nanoestruturados, tais como as formas buckyballs e nanotubos. Seus descobridores - Robert Curl, Harold Kroto e Richard Smalley - recebeu o Prêmio Nobel de Química em 1996. O interesse renovado resultando em novas formas levar à descoberta de novas allotropes exóticas, incluindo de carbono vítreo, ea percepção de que " carbono amorfo "não é estritamente amorfo.
Produção
Grafite
Comercialmente viáveis depósitos naturais de grafite ocorrem em muitas partes do mundo, mas as fontes mais importantes economicamente estão em China , Índia , Brasil e Coreia do Norte . Depósitos de grafite são de metamórfica origem, encontrados em associação com quartzo , mica e feldspato em xistos, gnaisses e metamorfoseado arenitos e calcário como lentes ou veias, por vezes, de um metro ou mais de espessura. Depósitos de grafite em Borrowdale, Cumberland, Inglaterra estavam em primeiro de tamanho e pureza suficientes de que, até o século 19, lápis foram feitos simplesmente por cortar blocos de grafite natural em tiras antes que encerra as tiras em madeira. Hoje, pequenos depósitos de grafite são obtidos por esmagamento da rocha-mãe e flutuando o grafite mais leve para fora na água.
Existem três tipos de naturais grafite amorfo, em flocos ou flake cristalino, e veia ou caroço. Grafite amorfo é a menor qualidade e mais abundante. Contrariamente à ciência, na indústria "amorfo" refere-se ao tamanho de cristal muito pequenas, em vez de completa falta de estrutura de cristal. Amorfo é usado para menor valor produtos de grafite e grafite é o mais baixo preço. Grandes depósitos de grafite amorfas são encontrados na China, Europa, México e Estados Unidos. Flake grafite é menos comum e de maior qualidade do que amorfo; ele ocorre como placas separadas que se cristalizaram em rocha metamórfica. Flake grafite pode ser quatro vezes o preço do amorfo. Bons flocos de qualidade pode ser transformado em grafite expansível para muitos usos, tais como a retardadores de chama. Os depósitos mais importantes encontram-se na Áustria, Brasil, Canadá, China, Alemanha e Madagascar. Veia ou grafite nódulo é a, mais valioso, e mais alta qualidade tipo mais raro de grafite natural. Ocorre em veias ao longo contatos intrusivos em nódulos sólidos, e é apenas comercialmente extraído no Sri Lanka.
De acordo com USGS, a produção mundial de grafita natural foi de 1,1 milhões de toneladas em 2010, para o qual a China contribuiu com 800,00 t, Índia 130.000 t, Brasil 76.000 t, Coreia do Norte e Canadá 30.000 t 25.000 t. Sem grafita natural foi relatado extraído nos Estados Unidos, mas 118 mil t de grafite sintética, com um valor estimado de 998 milhões dólares foi produzido em 2009.
Diamante
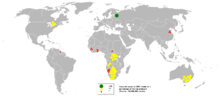
A cadeia de abastecimento de diamante é controlada por um número limitado de empresas poderosas, e é também altamente concentrado num pequeno número de locais em todo o mundo (ver figura).
Somente uma fração muito pequena do minério do diamante consiste em diamantes reais. O minério é moído, durante o qual o cuidado deve ser tomado para evitar que os diamantes maiores sejam destruídos neste processo e, subsequentemente, as partículas são classificadas pela densidade. Hoje em dia, os diamantes estão localizados na fracção de densidade ricas em diamante com a ajuda de Fluorescência de raios-X, depois que as etapas finais de classificação são feitas à mão. Antes da utilização de Raios-X tornou-se comum, a separação foi feita com correias de graxa; diamantes têm uma tendência mais forte para furar a graxa do que os outros minerais no minério.
Historicamente eram conhecidos diamantes para ser encontrado apenas em depósitos aluviais em sul da Índia. Índia liderou o mundo na produção do diamante da época de sua descoberta aproximadamente no século aC ao século 9 AD de mid-18th, mas o potencial comercial destas fontes tinha sido esgotado no final do século 18 e, naquele tempo, a Índia foi eclipsado por Brasil onde os primeiros diamantes não-índios foram encontrados em 1725.
A produção de diamantes de depósitos primários (kimberlitos e lamproítos) só começaram na década de 1870 após a descoberta dos campos de diamante na África do Sul. A produção aumentou ao longo do tempo e agora um total acumulado de 4,5 mil milhões de quilates foram minadas desde essa data. Cerca de 20% desse montante foi minada nos últimos 5 anos sozinho, e durante os últimos dez anos 9 novas minas começaram a produção enquanto mais quatro estão esperando para ser aberto em breve. A maioria dessas minas estão localizadas no Canadá, Zimbabwe, Angola, e um na Rússia.
Nos Estados Unidos, os diamantes foram encontrados em Arkansas, Colorado e Montana. Em 2004, uma surpreendente descoberta de um diamante microscópico nos Estados Unidos levou à maior amostragem de janeiro 2008 tubos de kimberlito em uma parte remota do Montana.
Hoje, depósitos de diamantes comercialmente mais viáveis estão em Rússia , Botswana , Austrália e República Democrática do Congo . Em 2005, a Rússia produziu quase um quinto da produção mundial de diamantes, relata o British Geological Survey. A Austrália tem o mais rico tubo diamantífero com a produção atingindo níveis máximos de 42 toneladas métricas (41 toneladas longas; 46 toneladas curtas) por ano na década de 1990. Existem também depósitos comerciais sendo ativamente minadas no Territórios do Noroeste do Canadá , Sibéria (na maior parte em Yakutia território; por exemplo, Tubo de Mir e Udachnaya pipe), no Brasil e no norte e ocidental Austrália .
Aplicações






O carbono é essencial para todos os sistemas vivos conhecidos, e sem ele a vida como a conhecemos não poderia existir (ver bioquímica alternativa). O principal uso econômico da excepção de alimentos e madeira de carbono é na forma de hidrocarbonetos, principalmente o combustível fóssil metano gás e petróleo bruto (petróleo). O petróleo bruto é utilizado pela indústria petroquímica para produzir, entre outras coisas, gasolina e querosene, através de uma destilação processo, em refinarias. A celulose é um polímero contendo carbono natural produzida pelas plantas na forma de algodão , linho e cânhamo. A celulose é principalmente utilizado para a manutenção da estrutura em plantas. Comercialmente valiosas polímeros de carbono de origem animal incluem lã , cashmere e seda. Plastics são feitos a partir de polímeros de carbono sintéticos, muitas vezes com átomos de oxigênio e nitrogênio incluído em intervalos regulares na cadeia polimérica principal. As matérias-primas para muitas destas substâncias sintéticas provenientes de óleo em bruto.
Os usos de carbono e seus compostos são extremamente variados. Ele pode formar ligas com ferro , das quais a mais comum é de aço carbono. A grafite é combinado com argilas para formar o "principal" utilizado em lápis usados para escrita e desenho . É também usado como um lubrificante e um pigmento , tal como um material de moldagem em vidro fabrico, em eletrodos secos para baterias e em galvanoplastia e galvanoplastia, em escovas para motores elétricos e como um moderador de nêutrons em reatores nucleares.
O carvão vegetal é usado como um material de desenho em obras de arte , para grelhar, e em muitos outros usos, incluindo a fundição de ferro. Madeira, o carvão eo petróleo são usados como combustível para a produção de aquecimento energia e espaço. Gem qualidade do diamante é usado em jóias e diamantes industriais são utilizados na perfuração, corte e polimento ferramentas para usinagem de metais e pedras. Os plásticos são feitos a partir de hidrocarbonetos fósseis, e fibra de carbono, por pirólise de sintéticas de poliéster fibras é utilizado para reforçar plásticos para formar avançada, leves materiais compósitos. A fibra de carbono é feito por pirólise de extrudida e estirada filamentos de poliacrilonitrilo (PAN) e outra orgânica substâncias. A estrutura e propriedades mecânicas cristalográficos da fibra dependem do tipo de material de partida, e no processamento subsequente. As fibras de carbono feitas a partir de PAN tem estrutura semelhante a filamentos estreitas de grafite, mas o processamento térmico pode reordenar a estrutura em uma chapa laminada contínua. O resultado é mais elevado de fibras com resistência específica à tracção do que o aço.
O negro de carbono é usado como o preto pigmento na impressão tinta, tinta a óleo e água cores do artista, papel carbono, acabamentos automotivos, Índia tinta e impressora a laser toner. O negro de carbono também é usado como um enchimento em borracha produtos como pneus e plásticos compostos. O carvão ativado é usado como um absorvente e adsorvente em material filtrante em aplicações tão diversas como máscaras de gás, purificação de água e cozinha exaustores e na medicina para absorver as toxinas, venenos, ou gases do sistema digestivo. O carbono é usado na redução química a temperaturas elevadas. coque é utilizado para reduzir minérios de ferro em ferro. endurecimento caso do aço é conseguida por aquecimento terminado componentes de aço carbono em pó. carbonetos de silício, tungsténio, boro e de titânio, estão entre os mais conhecidos materiais, e são usados como abrasivos em corte e em ferramentas de moagem. Os compostos de carbono compõem a maioria dos materiais usados em roupas, como naturais e sintéticos têxteis e couro, e quase todas as superfícies interiores do ambiente construído não de vidro, pedra e metal.
Diamonds
O diamante indústria podem ser amplamente divididas em duas categorias distintas: basicamente uma negociação com diamantes jóia de grau e outro para os diamantes de nível industrial. Enquanto existe um grande comércio de ambos os tipos de diamantes, os dois mercados agir de forma dramaticamente diferentes.
Um grande comércio dediamantes jóia existe grau. Ao contrário metais preciosos como oouroouplatina, diamantes gema não o comércio como umamercadoria: há uma substancial margem de lucro na venda de diamantes, e não há um mercado muito ativo para revenda de diamantes.
O mercado de diamantes de nível industrial opera de forma muito diferente de sua contraparte gem-grade. Diamantes industriais são avaliados principalmente por sua dureza e condutividade térmica, tornando muitas das características de Gemological de diamante, incluindo clareza e cor, em grande parte irrelevante. Isso ajuda a explicar por que 80% dos diamantes extraídos (o equivalente a cerca de 100 milhões de quilates ou 20 toneladas por ano), inadequadas para o uso como pedras preciosas e conhecidos como bort , são destinados para uso industrial. Além de minas de diamantes, diamantes sintéticos encontrados aplicações industriais quase que imediatamente após a sua invenção na década de 1950; mais de 3 bilhões de quilates (600 toneladas) de diamante sintético é produzido anualmente para uso industrial. O uso industrial dominante de diamante está em corte, perfuração, moagem e polimento. A maioria dos usos de diamantes nestas tecnologias não requerem grandes diamantes; na verdade, a maioria dos diamantes que são gema de qualidade, exceto para seu pequeno tamanho, pode encontrar um uso industrial. Os diamantes são incorporados em brocas de perfuração ou lâminas de serra, ou moído em um pó para uso em aplicações de lixamento e polimento. Aplicações especializadas incluem o uso em laboratórios como de contenção para experimentos de alta pressão (ver bigorna de diamante), de alto desempenho rolamentos, e uso limitado em especializados janelas. Com os contínuos avanços sendo feitos na produção de diamantes sintéticos, aplicações futuras estão começando a se tornar viável. Ganhando muita emoção é o possível uso do diamante como um semicondutor adequado para construir microchips de, ou o uso do diamante como um dissipador de calor em eletrônica .
Precauções

Carbono puro tem extremamente baixa toxicidade para os seres humanos e pode ser manuseado com segurança e mesmo ingerida na forma de grafite ou de carvão. É resistente à dissolução ou ataque químico, mesmo nas conteúdo ácido do tracto digestivo, por exemplo. Consequentemente, uma vez que entra em tecidos do corpo é provável que permanecem lá indefinidamente. O negro de carbono foi, provavelmente, um dos primeiros pigmentos a serem utilizados para a tatuagem, e Ötzi o Iceman foi encontrado para ter tatuagens de carbono que sobreviveram durante a sua vida e para 5200 anos depois de sua morte. No entanto, a inalação do pó de carvão ou de fuligem ( negro de fumo) em grandes quantidades pode ser perigosa, irritar os tecidos do pulmão e fazendo com que o congestiva doença pulmonar Antracose. Da mesma forma, pó de diamante usado como um abrasivo pode fazer mal se ingerido ou inalado. As micropartículas de carbono são produzidos gases de escape em motores diesel, e pode acumular-se nos pulmões. Nestes exemplos, os efeitos nocivos podem resultar de contaminação das partículas de carbono, com os produtos químicos orgânicos ou de metais pesados, por exemplo, em vez de a partir do próprio carbono.
Carbono geralmente tem baixa toxicidade para quase todos a vida na Terra ; no entanto, para algumas criaturas que ainda pode ser tóxico - por exemplo, nanopartículas de carbono estão toxinas mortais para Drosophila .
Carbono podem também queimar vigorosamente e brilhantemente na presença de ar a temperaturas elevadas, tal como no fogo Windscale, que foi causada pela libertação repentina de armazenada energia Wigner no núcleo de grafite. Grandes acumulações de carvão, que permaneceram inertes para centenas de milhões de anos, na ausência de oxigênio, pode entrar em combustão espontânea quando exposta ao ar, por exemplo, em aterros das minas de carvão.
A grande variedade de compostos de carbono incluem tais venenos letais como a tetrodotoxina, a lectina ricina a partir de sementes da mamona Ricinus communis , cianeto (CN - ) e monóxido de carbono; e bens essenciais à vida como glicose e proteínas .
Criar Laços de carbono
| CH | Ele | ||||||||||||||||
| CLi | CBE | CB | CC | CN | CO | CF | Ne | ||||||||||
| CNA | CMG | Cal | CSi | CP | CS | CCl | CAr | ||||||||||
| CK | CCa | CSc | CTi | CV | CCr | CMN | CFE | CCo | CNi | CCu | CZN | CGA | CGE | CAs | CSE | CBr | CKR |
| CRb | RSE | CY | CZR | CNB | CMo | CTC | CRu | CRH | CPD | CAg | CCd | CIn | CSn | CSB | CTE | CI | CXE |
| CCs | CBA | CHF | CTA | CW | CRe | COs | CIR | CPt | Cau | CHG | CTL | CEC | CBi | CPO | Gato | Rn | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | UUP | Lv | Uus | UUO | |
| ↓ | |||||||||||||||||
| CLa | CCE | CPr | CND | Pm | CSM | CEU | CGD | CTb | CDY | Cho | CER | CTM | CYB | Clu | |||
| CA | CTH | CPA | CU | CNP | CPU | Excêntrico | CCM | CBK | Cf | EC | Fm | Md | Não | Lr | |||
| Química orgânica núcleo | Muitos usos em química |
| A pesquisa acadêmica, mas não uso generalizado | Vínculo desconhecido |
