
Elemento químico
Fundo para as escolas Wikipédia
Crianças SOS, uma instituição de caridade educação , organizou esta selecção. Uma boa maneira de ajudar outras crianças é por patrocinar uma criança
Um elemento químico, ou elemento, é um tipo de átomo , que se distingue pela sua número atómico ; isto é, pelo número de protões no seu núcleo . O termo é também usado para se referir a um produto químico puro substância composta de átomos com o mesmo número de protões.
Os exemplos mais comuns de elementos são hidrogénio , carbono , azoto , e oxigénio . No total, 117 elementos foram observados a partir de 2007, dos quais 94 ocorrem naturalmente na Terra. Elementos com números atômicos maiores de 82 ( bismuto e acima) são inerentemente instáveis, e submeter-se decaimento radioativo. Dos primeiros 82 elementos, 80 têm estáveis isótopos . Elementos 43 e 61 ( tecnécio e promethium ) não têm isótopos estáveis, e decadência. Os elementos de 83 para 94 o número atômico que não têm núcleos estáveis, são, no entanto, encontrados na natureza, quer sobreviver como remanescentes da nucleossíntese estelar primordial que produziu os elementos no sistema solar, ou então como são produzidos como filha mais recentes-isótopos de vida curta no decaimento natural do urânio e tório .
Todos os matéria química consiste destes elementos. Novos elementos de número atómico superior são descobertos ao longo do tempo, como produtos de artificial reações nucleares.
História
O termo 'elementos' (stoicheia) foi usado pela primeira vez pelo filósofo grego Platão em cerca de 360 aC, em seu diálogo Timeu, que inclui uma discussão da composição de corpos inorgânicos e orgânicos e é um tratado rudimentar em química. Plato assumido que a partícula de cada elemento minutos correspondia a um dos poliedros regulares: tetraedro (fogo), octaedro (ar), icosaedro (água), e cubo (terra).
 | 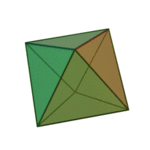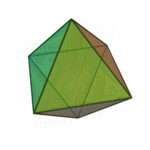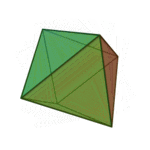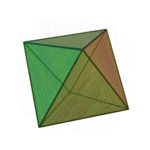 | 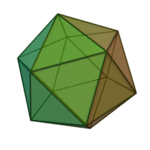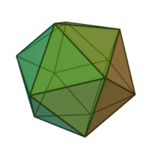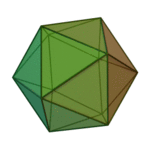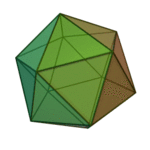 | 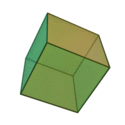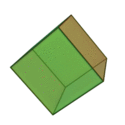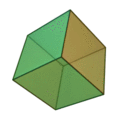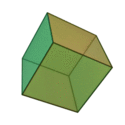 | |
| Tetraedro (fogo) | Octahedron (ar) | Icosahedron (água) | Cube (terra) |
Somando-se a quatro elementos do filósofo grego Empédocles, em cerca de 350 aC, Aristóteles também usou o termo "elemento" e concebeu um quinto elemento chamado " quintessência ", que formaram os céus Aristóteles definiu um elemento como.:
Elemento de - um desses corpos em que outros corpos podem ser decompostas e que por si só não é capaz de ser dividido em outra.
Com base nesta teoria, em c. 790 químico Árabe Jabir ibn Hayyan-( Geber) postulou que os metais foram formados por dois elementos: enxofre, a pedra que arde ", que caracterizou o princípio da combustibilidade, eo mercúrio, que continha o princípio idealizado de propriedades metálicas. Pouco tempo depois, este evoluiu para o conceito árabe dos três princípios: enxofre dando inflamabilidade ou de combustão, mercúrio dando volatilidade e estabilidade, e sal que dá solidez.
Em 1524, o químico suíço Paracelso adotou quatro teoria elemento de Aristóteles, mas argumentou que eles apareceram em corpos como três princípios de Geber. Paracelso viu estes princípios como fundamentais, e justifica-los através do recurso à descrição de como madeira queima no fogo. Mercury incluído o princípio de coesão, de modo que quando saiu na fumaça da madeira se desfez. Smoke representou a volatilidade (o princípio de mercúrio), as chamas que dá calor representado inflamabilidade (enxofre), e as cinzas remanescentes representados solidez (sal).
Em 1669, o médico alemão e químico Johann Becher publicou seu Physica Subterranea. Na modificação nas idéias de Paracelso, ele argumentou que os constituintes de corpos são ar, água, e três tipos de terra: terra fluida, o elemento mercurial, o que contribui fluidez e volatilidade; lapida terra, o elemento de solidificação, que produz ou fusibilidade a qualidade de ligação; e terra pinguis, o elemento gordo, o que dá substância material suas qualidades oleosas e combustíveis. Estas três terras corresponder com três princípios de Geber. Um pedaço de madeira, por exemplo, de acordo com Becher, é composto por cinzas e terra pinguis; quando a madeira é queimada, a pinguis terra é libertada, deixando as cinzas. Em outras palavras, na combustão da terra gordo queima.
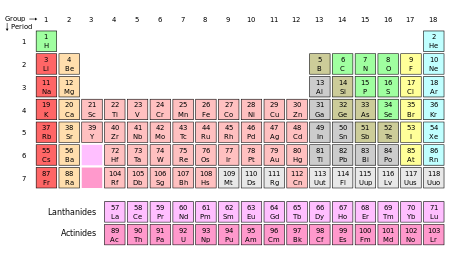
Em 1661, Robert Boyle mostrou que havia mais do que apenas quatro elementos clássicos como os antigos tinham assumido. A primeira lista moderna de elementos químicos foi dada em Antoine Lavoisier 's 1789 Elements of Chemistry, que continha trinta e três elementos, incluindo luz e calórica. Por 1818, Jöns Jakob Berzelius tinha determinado pesos atômicos para quarenta e cinco dos quarenta e nove elementos aceitos. Dmitri Mendeleev tinha sessenta e seis elementos em sua tabela periódica de 1869, mostrado abaixo.

De Boyle até o início do século 20, um elemento foi definido como um puro substância que não pode ser decomposto em qualquer substância simples. Dito de outra maneira, um elemento químico não pode ser transformado em outros elementos químicos por químicos processos. Em 1913, Henry Moseley descobriu que a base física do número atômico do átomo era a sua carga nuclear, o que levou à atual definição. A actual definição também evita algumas ambigüidades, devido à isótopos e allotropes .
Em 1919, foram setenta e dois elementos conhecidos. Em 1955, elemento 101 foi descoberto e nomeado mendelevium em honra de Mendeleev, o primeiro a organizar os elementos de forma periódica. Em outubro de 2006, a síntese do elemento 118 foi relatada; no entanto, o elemento 117 ainda não foi criada no laboratório.
Descrição
Os elementos mais leves são de hidrogênio e hélio , ambos criados por Nucleossíntese do Big Bang durante o primeiros 20 minutos do universo em um proporção de cerca de 3: 1, em massa, (cerca de 12: 1 pelo número de átomos). Quase todos os outros elementos encontrados na natureza, incluindo alguns mais hidrogênio e hélio criados desde então, foram feitas por várias (vezes) na naturais ou métodos artificiais de nucleossíntese, incluindo ocasionalmente por atividades como a fissão nuclear .
A partir de 2006, existem 117 elementos conhecidos (neste contexto, "conhecido" significa observou bem o suficiente, mesmo de apenas alguns produtos de decaimento, ter sido diferenciado de qualquer outro elemento). Destes 117 elementos, 94 ocorrem naturalmente na Terra. Seis destes ocorrem em pequenas quantidades extremas: tecnécio , número atômico 43; promethium , número 61; astatine , número 85; francium , número 87; neptunium , número 93; e plutônio , número 94. Estes 94 elementos, e também, possivelmente, elemento 98 califórnio , foram detectados no universo em geral, nos espectros de estrelas e supernovas também, onde elementos radioactivos de vida curta são recém-feitos.
Os restantes 22 elementos não encontrado na Terra ou em espectros astronômicos foram derivados artificialmente. Todos os elementos que são derivados unicamente através de meios artificiais são radioactivos com muito curtas semi-vidas ; se quaisquer átomos desses elementos estavam presentes na formação da Terra, eles são extremamente propensos a ter já deteriorado, e se presente em novae, foram em quantidades pequenas demais para ter sido notado. Tecnécio foi o primeiro elemento alegadamente não natural para ser sintetizada, em 1937, embora quantidades vestigiais de tecnécio, uma vez tenham sido encontrados na natureza, e o elemento pode ter sido descoberto naturalmente em 1925. Este padrão de produção artificial e natural, descoberta mais tarde foi repetido com diversos outros elementos vestigiais ocorrem naturalmente radioactivos .
As listas dos elementos pelo nome , por símbolo, pelo número atômico, por densidade, por ponto de fusão, e por ponto de ebulição, bem como Energias de ionização dos elementos estão disponíveis. A apresentação mais conveniente dos elementos está na tabela periódica , que grupos elementos com propriedades químicas semelhantes.
Número atômico
O número atómico de um elemento, Z, é igual ao número de protões que define o elemento. Por exemplo, todos de carbono átomos de conter 6 prótons em seu núcleo ; de modo que o número atómico "Z" de carbono é de 6 átomos de carbono podem ter diferentes números de neutrões, que são conhecidos como isótopos do elemento.
O número de prótons no núcleo atômico também determina a sua carga elétrica , que por sua vez determina os elétrons do átomo em seu estado não-ionizada. Este, por sua vez (por meio do Princípio de exclusão de Pauli) determina o átomo de vária propriedades químicas. Assim, todos os átomos de carbono, por exemplo, em última análise, têm propriedades químicas idênticas porque todos eles têm o mesmo número de protões no seu núcleo, e, portanto, têm o mesmo número atómico. É por esta razão que o número atômico, em vez de número de massa (ou peso atômico) é considerado a característica de identificação de um elemento.
Massa atômica
O número de massa de um elemento, A, é o número de núcleons (prótons e nêutrons) do núcleo atômico. Isótopos diferentes de um dado elemento são distinguidos pelos seus números de massa, que são convencionalmente escritos como um super-índice do lado esquerdo do símbolo atómico (por exemplo, 238 L).
O massa atómica relativa de um elemento é igual à média das massas atómicas de todos os isótopos do elemento químico, tal como encontrada num ambiente particular, ponderada pela abundância isotópica, em relação ao unidade de massa atômica (u). Este número pode ser uma fracção que não está próximo de um número inteiro, devido ao processo de cálculo da média. Por outro lado, a massa atómica de um isótopo puro é muito próximo do seu número de massa. Considerando que o número de massa é um número natural (ou conjunto), a massa atômica de um único isótopo é um número real que está perto de um número natural. De um modo geral, que difere ligeiramente do número de massa como a massa dos protões e neutrões não é exactamente 1 u, os electrões também contribuem pouco para a massa atómica, e por causa da energia de ligação nuclear. Por exemplo, a massa de 19 M é 18,9984032 u. A única excepção para a massa atómica de um isótopo não ser um número natural é 12 C, que tem uma massa de exactamente 12, devido à definição de L (que é fixado como 1/12 da massa de uma ligação carbono-12 livre átomo, exatamente).
Isótopos
Isótopos são átomos do mesmo elemento (isto é, com o mesmo número de protões no seu núcleo atómico), mas tendo diferentes números de neutrões . A maioria (66 de 94) que ocorrem naturalmente elementos têm mais de um isótopo estável. Assim, por exemplo, existem três isótopos principais de carbono . Todos os átomos de carbono tem 6 prótons no núcleo, mas eles podem ter ou 6, 7, 8 ou nêutrons. Uma vez que os números de massa destes são 12, 13 e 14, respectivamente, as três isótopos de carbono são conhecidos como carbono-12, carbono-13, e de carbono-14, frequentemente abreviado para 12 C, 13 C e 14 C. Carbono na vida quotidiana e em química é uma mistura de 12 C, 13 C e 14 átomos de carbono.
Todos os três isótopos de carbono têm as mesmas propriedades químicas. Mas eles têm diferentes propriedades nucleares. Neste exemplo, carbono-12, e de carbono-13 são átomos estáveis, mas carbono-14 é instável; é ligeiramente radioactivos, decaindo com o tempo em outros elementos.
Como o carbono, alguns isótopos de vários elementos são radioativo e decadência em outros elementos sobre irradiando uma partícula alfa ou beta. Para alguns elementos, todos os seus isótopos são isótopos radioativos: especificamente os elementos sem quaisquer isótopos estáveis são tecnécio (número atómico 43), o promécio (número atômico 61), e todos os elementos observados com números atômicos maiores de 82.
Dos 80 elementos com um isótopo estável, 16 tem apenas um isótopo estável, e o número médio de isótopos estáveis para os 80 elementos estáveis é 3,4 isótopos estáveis por elemento. O maior número de isótopos estáveis que ocorrem para um elemento é de 10 (para o estanho, elemento 50).
Allotropes
Alguns elementos podem ser encontrados como várias substâncias elementares, conhecidos como allotropes , que diferem na sua estrutura e propriedades. Por exemplo, o carbono pode ser encontrado como diamante , que tem uma estrutura tetraédrica em torno de cada átomo de carbono; grafite, que tem camadas de átomos de carbono com uma estrutura hexagonal, e fulerenos, que têm formas quase esféricas. A capacidade de um elemento de existir em uma de muitas formas estruturais é conhecido como 'allotropy'.
Estado padrão
O estado padrão, ou estado de referência, de um elemento é definido como o estado termodinamicamente mais estável em 1 bar, a uma determinada temperatura (tipicamente a 298,15 K). Em termoquímica, um elemento é definido para ter uma entalpia de formação de zero no seu estado normal. Por exemplo, o estado de referência de carbono de grafite é, porque é mais estável do que as outras formas alotrópicas.
Nomenclatura
A nomeação de elementos precede a teoria atômica da matéria, embora na época não se sabia quais eram elementos químicos e quais compostos. Quando se soube, os nomes existentes (por exemplo, ouro, mercúrio, ferro) foram mantidas na maioria dos países, e as diferenças nacionais surgiram ao longo dos nomes de elementos ou de conveniência, sutilezas lingüísticas, ou nacionalismo. Por exemplo, os alemães usam "Wasserstoff" para "hidrogênio" e "Sauerstoff" para "oxigênio", enquanto Inglês e alguns línguas românicas usar "sódio" para "natrium" e "potássio" para "kalium", e os franceses, gregos e polacos preferem "azote / azot" para "nitrogênio".
Mas para o comércio internacional, o nomes oficiais dos elementos químicos antigas e recentes são decididos pelo União Internacional de Química Pura e Aplicada, que decidiu em um tipo de linguagem internacional Inglês. Essa organização foi recentemente prescrito que "alumínio" e "de césio" tomar o lugar de os EUA grafias "alumínio" e "de césio", enquanto o "enxofre" US toma o lugar do "enxofre" britânico. Mas os produtos químicos que são praticáveis para ser vendido a granel no interior de muitos países, no entanto, ainda tem nomes nacionais, e aqueles que não usam o alfabeto latino não se pode esperar para usar o nome IUPAC. De acordo com a IUPAC, o nome completo de um elemento não é capitalizado, mesmo se ele é derivado de um nome próprio, como a elementos califórnio ou einsteinium (a menos que seria capitalizado por algum outro regra). Isótopos de elementos químicos também estão com inicial minúscula, se escrito: carbono-12 ou urânio-235.
Na segunda metade dos laboratórios de física do século XX tornou-se capaz de produzir núcleos de elementos químicos que têm uma meia-vida muito curta para que eles permaneçam em quantidades apreciáveis. Estes também são nomeados pela IUPAC, que geralmente adota o nome escolhido pelo descobridor. Isto pode conduzir à questão de qual grupo controversa pesquisa na verdade descobriu um elemento, uma questão que atrasou a nomenclatura dos elementos com número atómico de 104 e mais elevado durante um tempo considerável. (Ver elemento polêmica nomeação).
Precursores de tais controvérsias envolveu os namings nacionalistas de elementos no final do século XIX. Por exemplo, lutécio foi nomeada em referência a Paris, França. Os alemães estavam relutantes em abrir mão de naming rights para o francês, muitas vezes chamando-cassiopeium. O descobridor britânico de nióbio originalmente nomeou-columbium, em referência ao Novo Mundo. Ele foi amplamente utilizado como tal por publicações americanas anteriores à normalização internacional.
Os símbolos químicos
Elementos químicos específicos
Antes química tornou-se uma ciência, alquimistas tinha desenhado símbolos misteriosos para ambos os metais e compostos comuns. Estes foram, contudo, utilizado como abreviaturas nos diagramas ou procedimentos; não havia o conceito de átomos que se combinam para formar moléculas. Com os avanços na teoria atômica da matéria, John Dalton inventou seus próprios símbolos mais simples, com base em círculos, que estavam a ser usado para descrever moléculas.
O actual sistema de notação química foi inventado por Berzelius. Neste sistema tipográfico símbolos químicos não são usados como meras siglas - embora cada um é composto por letras do alfabeto latino - eles são símbolos destinados a serem utilizados por povos de todas as línguas e alfabetos. O primeiro desses símbolos foram destina-se a ser inteiramente universal; uma vez que o latim era a língua comum da ciência naquela época, eles eram abreviaturas com base nos latino nomes de metais - Fe vem de Ferrum, Ag de Argentum. Os símbolos não foram seguidos por um ponto (ponto final) como abreviaturas foram. Mais tarde, os elementos químicos também foram atribuídos os símbolos químicos originais, com base no nome do elemento, mas não necessariamente em Inglês. Por exemplo, de sódio tem o símbolo químico "Na 'após o sódico Latina. O mesmo se aplica a "W" (volfrâmio) para tungstênio , "Hg" (hydrargyrum) para mercúrio , "K" (kalium) para potássio , "Au" (aurum) para o ouro , "Pb" (plumbum) para liderança , e "Sb" (stibium) para antimônio .
Os símbolos químicos são entendidos internacionalmente quando os nomes dos elementos pode ter de ser traduzido. Às vezes há diferenças; por exemplo, os alemães usaram "J" em vez de "I" para o iodo, de modo que o personagem não ser confundido com um numeral romano .
A primeira letra de um símbolo químico está sempre em maiúsculas, como nos exemplos anteriores, e as letras seguintes, se existirem, são sempre minúsculas (letras pequenas).
Símbolos químicos Gerais
Existem também símbolos para série de elementos químicos, para as fórmulas comparativas. Estas são uma letra maiúscula de comprimento, e as letras são reservados para que eles não estão autorizados a ser dada para os nomes dos elementos específicos. Por exemplo, um "X" é utilizado para indicar um grupo variável entre uma classe de compostos (embora geralmente um halogéneo ), enquanto que "R" é utilizado para uma radical, significa uma estrutura composta tal como uma cadeia de hidrocarboneto. A letra "Q" está reservado para "calor" em uma reação química. "Y" também é utilizado frequentemente como um símbolo químico geral, embora seja também o símbolo de ítrio . "Z" também é freqüentemente usado como um grupo variável em geral. "L" é utilizado para representar um general ligando em química inorgânica e organometálica. "M" também é utilizado frequentemente em lugar de um metal em geral.
Símbolos de isótopos
Os três principais isótopos do elemento hidrogênio são muitas vezes escrito como H para protium, D para deutério e T para trítio. Isto é, a fim de torná-lo mais fácil de utilizar em equações químicas, uma vez que substitui a necessidade de escrever o número de massa para cada átomo. Está escrito assim:
D 2 O ( água pesada)
Em vez de escrevê-lo como este:
2 O ²H
Abundância
Durante as fases iniciais do Big Bang , nucleosíntese de núcleos de hidrogénio resultou na produção de isótopos de hidrogénio e do hélio, bem como quantidades muito minúsculas (da ordem de 10 -10) de lítio e berílio. Não há discussão sobre se ou não algum boro foi produzido no Big Bang, como tem sido observado em algumas estrelas muito jovens, mas há elementos mais pesados do que o boro foram produzidos. Como resultado, a abundância de primordial átomos consistiu de cerca de 75% 1 H, 25% 4 He, e 0,01% deutério. Enriquecimento posterior de halos galácticos ocorreu devido a Nucleossíntese estelar e Nucleossíntese supernova. Contudo espaço intergaláctico ainda pode se assemelham a abundância primordial, a menos que tenha sido enriquecida por alguns meios.
A tabela a seguir mostra os dez elementos mais comuns no nosso Galaxy (estimada espectroscopicamente), como medido em partes por milhão, em massa. Galáxias próximas que evoluíram ao longo de linhas similares têm um enriquecimento correspondente de elementos mais pesados que o hidrogênio eo hélio. As galáxias mais distantes estão sendo vistos como apareciam no passado, de modo que suas abundâncias de elementos aparecem mais perto da mistura primordial. Como as leis e processos físicos parecem comuns em todo o universo visível , no entanto, espera-se que essas galáxias da mesma forma irá ter evoluído abundâncias semelhantes de elementos.
| Elemento | Partes por milhão em massa |
|---|---|
| Hidrogênio | 739000 |
| Hélio | 240.000 |
| Oxigênio | 10.700 |
| Carbono | 4600 |
| Néon | 1340 |
| Ferro | 1090 |
| Azoto | 970 |
| Silício | 650 |
| Magnésio | 580 |
| Enxofre | 440 |
Elementos recentemente descoberto
O primeiro transurânico elemento (elemento com número atômico maior do que 92) foi descoberto neptunium em 1940. O elemento mais pesado que foi encontrado até o momento é o elemento 118, ununoctium , que foi sintetizado com sucesso em 9 de outubro de 2006, pela Flerov Laboratório de reações nucleares em Dubna, Rússia .
Elemento 117, Ununseptium, ainda não foi criado ou descoberto, embora o seu lugar na tabela periódica é preestabelecida, e da mesma forma para possíveis elementos para além 118.
