
John Dalton
Informações de fundo
Esta seleção Escolas foi originalmente escolhido pelo SOS Children para as escolas no mundo em desenvolvimento sem acesso à internet. Ele está disponível como um download intranet. Para comparar instituições de caridade de patrocínio esta é a melhor ligação de patrocínio .
| John Dalton | |
|---|---|
 | |
| Nascido | 06 de setembro de 1766 Eaglesfield, perto Cockermouth, Cumbria, Inglaterra |
| Morreu | 27 de julho de 1844 (77 anos) Manchester , Inglaterra |
| Conselheiro doutoral | John Gough |
| Os estudantes de doutorado | James Prescott Joule |
| Conhecido por | Teoria Atómica, Lei das proporções múltiplas, A lei de Dalton das pressões parciais, daltonismo |
John Dalton FRS ( 6 de setembro de 1766 - 27 de julho de 1844 ) foi um Inglês químico, meteorologista e físico, nascido em uma família Quaker em Eaglesfield, perto Cockermouth em Cumbria. Ele é mais conhecido por seu trabalho pioneiro no desenvolvimento da moderna teoria atômica, e sua pesquisa sobre daltonismo (por vezes referido como daltonismo, em sua honra).
Infância
O filho de um tecelão, com a idade de quinze John Dalton se juntou ao seu irmão mais velho Jonathan na gestão de uma escola Quaker na cidade vizinha de Kendal. Por volta de 1790 Dalton parece ter considerado, tendo-se o direito ou medicina , mas seus projetos não foram satisfeitas com o incentivo de seus parentes - Dissidentes foram impedidos de frequentar ou ensinar em universidades inglesas - e ele manteve-se em Kendal, até que, na primavera de 1793, ele se mudou para Manchester . Principalmente através de John Gough, um filósofo cego e polímata de cuja informal instrução que ele deve muito de seu conhecimento científico, Dalton foi nomeado professor de matemática e filosofia natural na "New College" em Manchester, uma academia Dissidente. Ele permaneceu nessa posição até 1800, quando a deterioração da situação financeira da faculdade o levou a renunciar ao posto e começar uma nova carreira no Manchester como professor particular para a matemática e filosofia natural.
Início da vida de Dalton foi altamente influenciado por um proeminente Eaglesfield Quaker nomeada Elihu Robinson, um meteorologista e instrumento fabricante competente, que o levou interessado em problemas de matemática e meteorologia. Durante seus anos em Kendal, Dalton contribuiu soluções de problemas e perguntas sobre vários assuntos para os Senhores e Senhoras da 'Diaries, e em 1787 ele começou a manter um meteorológica diário em que, durante os 57 anos subsequentes, ele entrou mais de 200.000 observações. A primeira publicação de Dalton era observações meteorológicas e Ensaios (1793), que continha as sementes de várias de suas descobertas mais tarde. No entanto, apesar da originalidade de seu tratamento, pouca atenção foi dada a eles por outros estudiosos. Um segundo trabalho de Dalton, Elementos de Inglês Gramática, foi publicado em 1801.
Em 1794, pouco depois de sua chegada a Manchester, Dalton foi eleito membro da Manchester sociedade literária e filosófica, o "Lit & Phil", e algumas semanas mais tarde, ele comunicou seu primeiro papel em "fatos extraordinários relacionados com a visão de cores ", no qual ele postulou que falta na percepção de cores foi causado por descoloração da meio líquido do globo ocular. Na verdade, a falta de percepção de cores em algumas pessoas nem sequer tinham sido descrita formalmente ou oficialmente notado até Dalton escreveu sobre o seu próprio. Embora a teoria de Dalton perdeu credibilidade em sua própria vida, da natureza exaustiva e metódica de sua pesquisa em seu próprio problema visual foi tão amplamente reconhecido que daltonismo tornou-se um termo comum para o daltonismo . O exame de seu globo ocular preservada em 1995 Dalton demonstraram que, na verdade, tinha um tipo menos comum de cegueira cor, deuteroanopia , no qual os cones sensíveis comprimento de onda médio estão ausentes (em vez de funcionar com uma forma mutada do seu pigmento, como no tipo mais comum de cor cegueira, deuteroanomaly ). Além da azul e roxo do espectro, ele foi capaz de reconhecer somente uma cor, amarelo, ou, como ele diz em seu artigo, "que parte da imagem que os outros chamam vermelho parece-me pouco mais do que uma sombra ou defeito de luz . Depois que o laranja, amarelo e verde parecem uma cor que desce consideravelmente uniformemente de um intenso a um amarelo raro, fazendo o que eu deveria chamar diferentes tons de amarelo ".
Este papel foi seguido por muitos outros sobre temas diversos sobre a chuva e orvalho ea origem do molas, sobre calor , a cor do céu, vapor, o verbos auxiliares e particípios do idioma Inglês eo reflexão e refração da luz.
Teoria atômica
Em 1800 ele se tornou um secretário da Manchester sociedade literária e filosófica, e no ano seguinte ele apresentou oralmente uma importante série de artigos, intitulada "Ensaios experimentais" sobre a constituição de mistos gases ; no a pressão de vapor de água e outros vapores, em diferentes temperaturas , tanto em um vácuo e em ar ; em evaporação; e na de expansão térmica dos gases. Estes quatro ensaios foram publicados nas Memórias do Lit & Phil em 1802.
O segundo destes essays abre com a observação impressionante,
- "Dificilmente poderia haver dúvida entretido respeitando a redutibilidade de todos os fluidos elásticos de qualquer tipo, em líquidos, e não devemos desesperar de afetá-lo em baixas temperaturas e por fortes pressões exercidas sobre os gases não misturados ainda mais. "
Depois de descrever experimentos para determinar a pressão de vapor em vários pontos entre 0 ° e 100 ° C (32 ° e 212 ° F), concluiu a partir de observações sobre a pressão de vapor de seis líquidos diferentes, que a variação da pressão de vapor para todos os líquidos é equivalente, para a mesma variação de temperatura, contando a partir do vapor de qualquer pressão.
No quarto ensaio, observa ele,
- "Eu não vejo nenhuma razão suficiente para que nós não podemos concluir que todos os fluidos elásticos sob a mesma pressão expandir igualmente pelo calor e que para qualquer expansão de mercúrio , a expansão correspondente do ar é proporcional algo menos, quanto maior a temperatura. Parece, por conseguinte, que as leis gerais respeitando a quantidade absoluta e a natureza do calor são mais susceptíveis de serem derivadas a partir de fluidos elástica do que a partir de outras substâncias. "
Assim, ele enunciou A lei de Gay-Lussac ou JAC A lei de Charles, publicado em 1802 por Joseph Louis Gay-Lussac. Nos dois ou três anos após a leitura destes ensaios, Dalton publicou vários artigos sobre temas semelhantes, que na absorção de gases por água e outros líquidos (1.803), contendo sua lei de pressões parciais agora conhecido como A lei de Dalton.
O mais importante de tudo investigações de Dalton são aqueles preocupados com a teoria atômica na química, com que seu nome está indissoluvelmente associado. Tem sido proposto que esta teoria foi sugerido a ele ou por pesquisas de etileno (gás olefiant) e metano (hidrogénio carburetted) ou por análise de óxido nitroso (protóxido de azoto) e dióxido de azoto (deutoxide de azoto), ambas as vistas que descansam na autoridade de Thomas Thomson. No entanto, um estudo de próprios cadernos de laboratório de Dalton, descobertos nos quartos do Lit & Phil, concluiu que, longe de Dalton que está sendo liderado por sua busca por uma explicação do lei das proporções múltiplas para a idéia que a combinação química consiste na interação de átomos do peso definitivo e característico, a idéia de átomos surgiu em sua mente como um conceito puramente físico, imposta a ele pelo estudo das propriedades físicas da atmosfera e outros gases . As indicações publicadas pela primeira vez desta ideia são para ser encontrados no final do seu papel na absorção de gases já mencionado, o qual foi lido em 21 outubro 1803 , embora não publicado até 1805. Aqui, ele diz:
- "Por que não admitir o seu volume de água de todo o tipo de gás iguais? Esta pergunta eu tenho devidamente considerada, e embora eu não sou capaz de me satisfazer completamente Eu estou quase convencido de que a circunstância depende do peso e do número de partículas finais de os vários gases. "
Ele passa a imprimir sua primeira tabela publicada de relativa pesos atômicos. Seis elementos aparecem nesta tabela, ou seja, hidrogênio, oxigênio, nitrogênio, carbono, enxofre e fósforo, com o átomo de hidrogênio convencionalmente assumido a pesar 1. Dalton fornecida nenhuma indicação nesse primeiro papel como ele tinha chegado a estes números. No entanto, em seu caderno de laboratório sob a data de 06 de setembro de 1803, aparece uma lista na qual ele define os pesos relativos dos átomos de um número de elementos, derivada da análise de água , amônia , dióxido de carbono , etc. pelos químicos da tempo.
Parece, então, que confrontado com o problema de calcular o diâmetro relativa dos átomos dos quais, ele estava convencido, todos os gases foram feitas, ele usou os resultados da análise química . Assistida pelo pressuposto de que a combinação ocorre sempre da maneira mais simples possível, ele, assim, chegou à idéia que a combinação química ocorre entre partículas de pesos diferentes, e foi isso o que diferencia sua teoria das especulações históricas dos gregos .
A extensão desta idéia às substâncias em geral, necessariamente, levou-o à lei de proporções múltiplas, ea comparação com experiência confirmou brilhante a sua dedução. Pode-se notar que, em um documento sobre a proporção dos gases ou líquidos elásticos que constituem a atmosfera, lida por ele em novembro de 1802, aparece a lei de proporções múltiplas para ser antecipada nas palavras: "Os elementos de oxigênio pode combinar com uma determinada parcela de gás nitroso ou com duas vezes a parte, mas com nenhuma quantidade intermediária ", mas não há razão para suspeitar que esta frase pode ter sido adicionado algum tempo após a leitura do artigo, que não foi publicado até 1805.
Os compostos foram listados como binários, ternários quaternário, etc. (moléculas compostas por dois, três, quatro, etc. átomos) no Novo Sistema de Filosofia Química, dependendo do número de átomos de um composto tinha em sua forma mais simples, empírica.
Ele a hipótese de a estrutura dos compostos pode ser representada em proporções de números inteiros. Assim, um átomo de elemento X combinação com um átomo de elemento Y é um composto binário. Além disso, um átomo de elemento X combinação com dois elementos de Y ou vice-versa, é um composto ternário. Muitos dos primeiros compostos listados no Novo Sistema de Filosofia Química correspondem a pontos de vista modernos, embora muitos outros não.
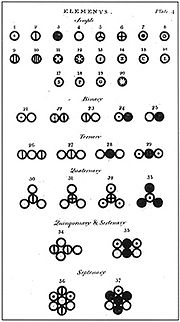
Dalton usou seus próprios símbolos para representar visualmente a estrutura atômica de compostos. Estes fizeram-lo em Novo Sistema de Filosofia Química onde Dalton listou uma série de elementos e compostos comuns.
Cinco pontos principais da teoria atômica de Dalton
- Os elementos são compostos de pequenas partículas chamadas átomos.
- Todos os átomos de um dado elemento são idênticos.
- Os átomos de um dado elemento são diferentes das de qualquer outro elemento; os átomos de diferentes elementos podem ser distinguidos uns dos outros pelos seus respectivos pesos relativos.
- Átomos de um elemento pode combinar com os átomos de outros elementos para formar compostos; um determinado composto tem sempre os mesmos números relativos de tipos de átomos.
- Átomos não pode ser criado, dividido em pequenas partículas, nem destruídas no processo químico; uma reação química simplesmente muda a forma como os átomos são agrupados.
Dalton propôs uma "regra de maior simplicidade" adicional que criou polêmica, uma vez que não pôde ser confirmada de forma independente.
- Quando os átomos se combinam em uma só razão, ".it deve ser presumido como um binário, a menos que alguma causa aparecem em contrário"
Esta foi apenas uma suposição, derivada da fé na simplicidade da natureza. Nenhuma evidência foi então à disposição dos cientistas deduzir quantos átomos de cada elemento se combinam para formar moléculas de compostos. Mas este ou algum outro tal regra era absolutamente necessário a qualquer teoria incipiente, já que um precisava de uma fórmula molecular assumidos com o objetivo de calcular pesos atômicos relativos. Em qualquer caso, "regra de maior simplicidade" de Dalton levou a supor que a fórmula da água era OH e amônia foi NH, bastante diferente da nossa compreensão moderna.
Apesar da incerteza no coração da teoria atômica de Dalton, os princípios da teoria sobreviveu. Para ter certeza, a convicção de que os átomos não podem ser subdivididos, criados ou destruídos em partículas menores quando eles são combinados, separados, ou reorganizados em reações químicas é inconsistente com a existência de fusão, cisão nuclear, mas tais processos são reações nucleares e não reacções químicas. Além disso, a idéia de que todos os átomos de um dado elemento são idênticos em suas propriedades físicas e químicas não é exatamente verdadeiro, como sabemos agora que os diferentes isótopos de um elemento têm diferentes pesos ligeiramente. No entanto, Dalton tinha criado uma teoria de imenso poder e importância. Na verdade, a inovação de Dalton foi totalmente tão importante para o futuro da ciência como Antoine Laurent Lavoisier química à base de oxigênio 's tinha sido.
Anos mais tarde
Dalton comunicou sua teoria atômica de Thomson que, por acordo, incluído um esboço do que na terceira edição de seu Sistema de Química (1807), e Dalton deu um novo conta de que na primeira parte do primeiro volume de seu novo sistema de Filosofia Química (1808). A segunda parte deste volume apareceu em 1810, mas a primeira parte do segundo volume não foi emitida até 1827. Este atraso não é explicado por qualquer excesso de cuidado na preparação, para muito do assunto estava fora da data eo apêndice dando Últimas opiniões do autor é a única parte do interesse especial. A segunda parte de vol. ii. nunca apareceu.
Dalton foi presidente da Lit & Phil de 1817 até sua morte, contribuindo 116 memórias. Destes, o mais cedo são os mais importantes. Em um deles, leia em 1814, ele explica os princípios da análise volumétrica, na qual ele foi um dos primeiros trabalhadores. Em 1840, um artigo sobre a fosfatos e arseniatos , muitas vezes considerado como um trabalho mais fraco, foi recusado pelo Royal Society, e ele estava tão irritado que ele publicou ele mesmo. Ele tomou o mesmo curso logo mais tarde com outros quatro trabalhos, dois dos quais (On a quantidade de ácidos , bases e sais em diferentes variedades de sais e em um método novo e fácil de analisar açúcar ) contêm sua descoberta, considerada por ele como o segundo em importância apenas para a teoria atômica, que certa anidratos, quando dissolvido em água, não causam aumento no seu volume, sendo a inferência de que o sal entra no poros da água.
Método experimental de Dalton
Como um investigador, Dalton foi muitas vezes áspero e com conteúdo instrumentos imprecisos, embora mais queridos foram obtidas. Sir Humphry Davy descreveu-o como "um experimentador muito grosseiro", que quase sempre encontrado os resultados que ele necessários, confiando a sua cabeça, em vez de suas mãos. Por outro lado, os historiadores que foram replicados alguns de seus experimentos cruciais confirmaram habilidade e precisão de Dalton.
No prefácio à segunda parte de vol. i. de seu novo sistema ele diz que tantas vezes tinha sido enganado por acatando os resultados de outros que ele decidiu escrever "o mínimo possível, mas o que eu posso atestar por minha própria experiência", mas esta independência ele carregou até agora que ele por vezes, se assemelhava a falta de receptividade. Assim, ele desconfiava, e provavelmente nunca totalmente aceito, conclusões Gay-Lussac de quanto aos volumes de gases que combinam. Ele tinha visões não convencionais sobre o cloro . Mesmo depois de seu caráter elementar tinha sido resolvido de Davy, ele insistiu em usar os pesos atômicos ele próprio tinha adoptado, mesmo quando eles tinham sido substituídos pelas determinações mais precisas de outros químicos. Ele sempre se opuseram à notação química planejada por Jöns Jakob Berzelius, embora a maioria pensou que era muito mais simples e mais conveniente do que o seu próprio sistema complicado de símbolos circulares.
A vida pública

Antes que ele havia proposto a teoria atômica, ele já tinha alcançado uma reputação científica considerável. Em 1804, ele foi escolhido para dar um curso de palestras sobre filosofia natural na Royal Institution em Londres , onde ele entregue um outro curso em 1809-1810. No entanto, algumas testemunhas relataram que ele era deficiente em as qualidades que fazem um professor atraente, sendo muito duro e indistinta na voz, ineficaz no tratamento de seu assunto, e singularmente querendo na língua e poder de ilustração.
Em 1810 Davy pediu-lhe para oferecer-se como um candidato para a bolsa da Royal Society, mas Dalton diminuiu, possivelmente por razões financeiras. No entanto, em 1822 ele foi proposto sem o seu conhecimento, e na eleição pagou a taxa de costume. Seis anos antes ele tinha sido feito um membro correspondente do Francês Académie des Sciences, e em 1830 ele foi eleito como um dos seus oito associados estrangeiros no lugar de Davy.
Em 1833, O governo de Lord Grey conferiu-lhe uma pensão de R $ 150, criado em 1836 para £ 300.
Dalton nunca se casou e teve apenas alguns amigos íntimos. Ele viveu por mais de um quarto de século com seu amigo, o Rev. W. Johns (1771-1845), na George Street, Manchester, onde sua rotina diária de trabalho de laboratório e aulas foi quebrado apenas pelo excursões anuais para o Lake District e visitas ocasionais a Londres. Em 1822 ele fez uma breve visita a Paris , onde conheceu muitos cientistas residentes ilustres. Ele participou de várias das reuniões anteriores do Associação Britânica pelo Iorque , Oxford , Dublin e Bristol .
Morte e legado

Dalton sofreu um pequeno derrame em 1837, e uma segunda em 1838 o deixou com um problema de fala, embora ele permaneceu capaz de fazer experimentos. Em maio de 1844, teve ainda um outro acidente vascular cerebral; em 26 de julho ele gravou com a mão trêmula sua última observação meteorológica. Em 27 de julho, em Manchester, Dalton caiu de sua cama e foi encontrado sem vida por seu assistente. Dalton foi enterrado em Manchester em Ardwick cemitério. O cemitério é agora um campo de jogo, mas as imagens da sepultura originais estão no livro de Patterson e o artigo de Elliott.
Um busto de Dalton, por Chantrey, foi subscrito publicamente e colocados no hall de entrada do Real Manchester Institution. Chantrey também trabalhada uma grande estátua de Dalton, agora na Manchester Town Hall.
Em homenagem ao trabalho de Dalton, muitos químicos e bioquímicos usar o (como de ainda não oficial) unidade dalton (Da abreviado) para denotar uma unidade de massa atómica, ou 1/12 do peso de um átomo de carbono neutro-12.
A Universidade de Manchester estabeleceu dois Dalton Química Bolsas Dalton, dois matemáticos bolsas de estudo e um prêmio Dalton de História Natural.
Em seu livro A 100, Michael H. Hart classifica Dalton como a pessoa mais influente 32 na história.
A cratera lunar foi nomeado após Dalton.
