
Etileno
Você sabia ...
Crianças SOS, que corre cerca de 200 sos escolas no mundo em desenvolvimento, organizado esta selecção. Crianças SOS tem cuidado de crianças na África por 40 anos. Você pode ajudar o seu trabalho na África ?
| Etileno | |
|---|---|
 | |
 |  |
Eteno | |
| Identificadores | |
| Número CAS | 74-85-1 |
| PubChem | 6325 |
| ChemSpider | 6085 |
| UNII | 91GW059KN7 |
| CE-número | 200-815-3 |
| KEGG | C06547 |
| Chebi | Chebi: 18153 |
| ChEMBL | CHEMBL117822 |
| Imagens-jmol 3D | Imagem 1 |
SMILES
| |
InChI
| |
| Propriedades | |
| Fórmula molecular | C 2 H 4 |
| Massa molar | 28,05 g / mol |
| Aparência | gás incolor |
| Densidade | 1,178 kg / m 3 a 15 ° C, gás |
| Ponto de fusão | -169,2 ° C (104,0 K, -272,6 ° F) |
| Ponto de ebulição | -103,7 ° C (169,5 K, -154,7 ° F) |
| Solubilidade em água | 3,5 mg / 100 ml (17 ° C); 2,9 mg / l |
| Solubilidade em etanol | 4,22 mg / L |
| Solubilidade em éter dietílico | bom |
| Acidez (p Ka) | 44 |
| Estrutura | |
| Forma molecular | 2h D |
| Momento de dipolo | zero |
| Termoquímica | |
| Entalpia padrão de formação Δ f H | 52,47 kJ / mol |
| Molar padrão entropia S | 219,32 J K -1 · · mol -1 |
| Perigos | |
| MSDS | MSDS External |
| Classificação da UE | Extremamente inflamável (F +) |
| NFPA 704 |  4 3 2 |
| Ponto de centelha | -136 ° C |
| De auto-ignição temperatura | 542,8 ° C |
| Os compostos relacionados | |
| Os compostos relacionados | Etano Acetileno |
| Página Suplementar dados | |
| Estrutura e Propriedades | N, ε r, etc. |
| Termodinâmica dados | Comportamento de fase Sólido, líquido, gasoso |
| Os dados espectrais | UV, IV, RMN , MS |
Excepto quando indicado, os dados são dados para materiais no seu estado normal (a 25 ° C, 100 kPa) | |
| Referências de Infobox | |
Etileno ( Nome IUPAC: eteno) é uma hidrocarboneto com a fórmula C 2 H 4 ou H 2 C = CH 2. É um gás inflamável incolor com um leve "doce e almiscarado "odor quando puro. É o mais simples alceno (com um hidrocarboneto carbono-carbono ligações duplas), e o mais simples hidrocarboneto insaturado depois de acetileno (C 2 H 2).
O etileno é amplamente utilizado na indústria química, e a sua produção em todo o mundo (mais de 109 milhões toneladas em 2006) supera a de qualquer outro composto orgânico. O etileno, também é um importante naturais hormônio vegetal, utilizado na agricultura para forçar o amadurecimento dos frutos.
Estrutura e propriedades
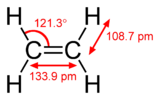
Este hidrocarboneto tem quatro hidrogénio átomos ligados a um par de carbono os átomos que estão ligados por um ligação dupla. Todos os seis átomos que compreendem etileno são coplanares. O HCH ângulo é de 119 °, perto do 120 ° para sp² ideal carbono híbrido. A molécula é também relativamente rígida: rotação em torno da ligação CC é um processo de alta energia que requer quebrar o π-bond.
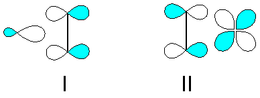
O π-bond na molécula de etileno é responsável pela sua reactividade útil. A ligação dupla é uma região de alta densidade de electrões, pelo que é susceptível ao ataque por electrófilos. Muitas reações de etileno são catalisadas por metais de transição, que se ligam transitoriamente ao etileno usando tanto o π e π * orbitais.
Sendo uma molécula simples, etileno é spectroscopically simples. A sua UV-vis espectro ainda é usado como um teste de métodos teóricos.
Usos
Principais reações industriais de etileno incluem, a fim de escala: 1) polimerização, 2) oxidação, 3) halogenação e hydrohalogenation, 4) alquilação, 5) hidratação, 6) oligomerização, e 7) hidroformilação. No Estados Unidos da América e Europa , cerca de 90% de etileno é usado para produzir três compounds- química óxido de etileno, dicloreto de etileno, e -etilbenzeno e uma variedade de tipos de polietileno.

Polimerização
Polietilenos de vários tipos consumir mais da metade do abastecimento de etileno mundo. Polietileno, também chamado de polietileno, é de plástico mais utilizado no mundo, sendo usado principalmente para fazer filmes usados em embalagem, sacos e lixo forros. Linear alfa-olefinas, produzidos pela oligomerização (formação de polímeros curtos) são usados como precursores, detergentes, plastificantes, lubrificantes sintéticos, aditivos, e também como co-monómeros para a produção de polietilenos.
Oxidação
O etileno é oxidado para produzir óxido de etileno, uma matéria prima chave na produção de surfactantes e detergentes por etoxilação. Óxido de etileno, também é hidrolisado para produzir etileno glicol, amplamente utilizado como um anti-congelante automóvel, bem como glicóis de elevado peso molecular, e éteres de glicol tereftalato de polietileno.
O etileno é submetido a oxidação por paládio para dar acetaldeído. Esta conversão continua sendo um grande processo industrial (10M kg / y). O processo prossegue através da complexação inicial de etileno de um catalisador de Pd (II) centro.
Halogenação e hydrohalogenation
Principais intermediários da halogenação e hydrohalogenation de etileno incluir dicloreto de etileno, cloreto de etilo e dibrometo de etileno. A adição do cloro implica "oxicloração", ou seja, em si de cloro não é utilizado. Alguns produtos derivados deste grupo são cloreto de polivinilo, tricloroetileno, percloroetileno, clorofórmio de metilo, cloreto de polivinilideno e copolímeros, e brometo de etilo.
Alkylation
Os principais produtos químicos intermédios a partir de alquilação com etileno é etilbenzeno, precursor estireno. O estireno é usado principalmente em poliestireno para embalagem e de isolamento, bem como em borracha de estireno-butadieno para pneus e calçados. Em menor escala, acetato de tolueno , ethylanilines, 1,4-hexadieno, e alumínio alquilos. Os produtos destas intermediários incluem poliestireno , insaturado poliésteres e de etileno-propileno terpolímeros.
Reacção oxo
O hidroformilação (reacção oxo) de resultados de etileno em propionaldeído, um precursor de ácido propiónico e álcool n-propilo.
Hidratação
Etileno tem representado por muito tempo o principal precursor não-fermentadoras de etanol . O método original implicou a sua conversão em sulfato de dietilo, seguido de hidrólise. O principal método praticado desde meados da década de 1990 é a hidratação direta de etileno catalisada por Os catalisadores ácidos sólidos:
- C 2 H 4 + H2O → CH 3 CH 2 OH
A dimerização de N-Butenos
O etileno pode ser dimerizada de n-butenos usando processos licenciados por Lummus ou IFP. O processo produz Lummus mistos n-butenos (principalmente 2-butenos) enquanto que o processo produz IFP 1-buteno.
Nicho usos
Um exemplo de uma utilização é como um nicho agente anestésico (numa razão oxigénio / 15% de etileno, 85%). Ele também pode ser usado para acelerar o amadurecimento dos frutos, bem como um gás de soldadura.
Produção
Produção mundial de eteno foi de 107 milhões de toneladas em 2005, 109 milhões de toneladas em 2006. NNFCC Químicos Renováveis Factsheet: Etanol, 138 milhões de toneladas em 2010 e 141 milhões de toneladas em 2011. Até 2010 etileno foi produzido por, pelo menos 117 empresas em 55 países. Para atender à crescente demanda por etileno, aumentos acentuados nas instalações de produção são adicionados a nível mundial, em particular no Oriente Médio e na China .
O etileno é produzido na indústria petroquímica por craqueamento a vapor. Neste processo, os hidrocarbonetos gasosos ou líquidos leves são aquecidos a 750-950 ° C, induzindo numerosos radicais livres reacções seguidas de imediato saciar a parar estas reacções. Este processo converte hidrocarbonetos grandes em partes menores e introduz insaturação. O etileno é separado da mistura de complexo resultante por repetidas compressão e destilação . Em um processo relacionado utilizado em refinarias de petróleo, hidrocarbonetos de elevado peso molecular estão rachadas sobre Os catalisadores de zeolite. Matérias-primas mais pesadas, tais como óleos de nafta e gás exigem pelo menos duas torres de "apagar" a jusante dos fornos de craqueamento para recircular gasolina derivada do processo de pirólise e água. Quando rachar uma mistura de etano e propano, apenas uma torre de atenuação da água é necessária.
As áreas de uma planta de eteno são:
- craqueamento a vapor fornos:
- recuperação de calor primário e secundário com efeito de atenuação;
- um sistema de reciclagem de vapor de diluição entre os fornos e no sistema de arrefecimento;
- compressão primária do gás craqueado (3 fases de compressão);
- sulfeto de hidrogênio e remoção de dióxido de carbono (remoção de gases ácidos);
- compressão secundária (1 ou 2 fases);
- secagem do gás de cracking;
- tratamento criogênico;
- toda a corrente de gás de cracking frio vai para a torre de desmetanação. A corrente de topo da torre de desmetanação consiste em todo o hidrogénio e o metano que era na corrente de gás de cracking. Criogenicamente (-250 ° F (-157 ° C)) tratar esta corrente de topo separa hidrogênio a partir de metano. Recuperação de Metano é fundamental para o funcionamento económico de uma planta de eteno.
- a corrente de fundo da torre desmetanizador vai para a torre desetanizador. A corrente de topo da torre desetanizador consiste de todo o C 2, 's que estavam na corrente gasosa do cracking. A corrente C 2 contém acetileno, que é explosiva acima de 200 kPa (29 psi). Se a pressão parcial de acetileno deverá ser superior a estes valores, o fluxo C 2 é parcialmente hidrogenado. Os C 2 's, em seguida, avançar para um divisor C 2. O etileno é tomado a partir da sobrecarga da torre e o etano proveniente da parte inferior do separador é reciclado para os fornos para ser quebrada de novo;
- a corrente de fundo da torre removedor de etano vai para a torre despropanizador. A corrente de topo da torre despropanizador consiste de todas as C 3 's que estavam no fluxo de gás de cracking. Antes de alimentar o C 3 's para o divisor de C 3, a corrente é hidrogenado para converter o e metilacetileno propadieno ( aleno) mistura. Esta corrente é então enviada para o divisor C 3. A corrente de topo do divisor C 3 é propileno produto ea corrente de fundo é o propano que é enviada de volta para os fornos para rachaduras ou utilizado como combustível.
- A corrente de fundo da torre despropanizador é alimentada à torre de desbutanizador. A corrente de topo do desbutanizador é todos os 4 C 's que estavam na corrente gasosa do cracking. A corrente de fundo do desbutanizador (gasolina de pirólise luz) consiste em tudo na corrente de gás que é rachado C 5 ou mais pesada.
Desde a produção de etileno é energia intensiva, muito esforço tem sido dedicado à recuperação de calor do gás que sai dos fornos. A maior parte da energia recuperada a partir do gás craqueado é usado para fazer de alta pressão (1200 psig) de vapor. Este vapor é, por sua vez utilizado para acionar as turbinas para compressão de gás rompido, o compressor de refrigeração de propileno, etileno e o compressor de refrigeração. Uma planta de eteno, uma vez em funcionamento, não precisa importar vapor para acionar suas turbinas a vapor. Uma planta típica de etileno escala mundial (cerca de 1,5 bilhões de libras de etileno por ano) usa uma potência de 45.000 (34.000 kW) compressor de gás rachado, uma de 30.000 hp (22.000 kW) compressor de propileno, e um de 15.000 hp (11.000 kW) compressor de etileno.
Síntese Laboratório
Apesar de grande valor industrialmente, o etileno é raramente usado em laboratório e é comumente comprado. Pode ser produzido por meio de desidratação de etanol com ácido sulfúrico ou na fase gasosa, com óxido de alumínio .
Etileno como um hormônio vegetal
Etileno serve como um hormona em plantas . Ele atua em níveis residuais ao longo da vida da planta, estimulando ou da regulação do amadurecimento da fruta , a abertura de flores , e a abscission (ou derramamento) de folhas. Salas de amadurecimento comerciais usam geradores "catalisador" para fazer o gás etileno a partir de um fornecimento de líquido de etanol. Tipicamente, um nível de gaseificao de 500 a 2000 ppm é usada, durante 24 a 48 horas. Cuidados devem ser tomados para controlar os níveis de dióxido de carbono em salas de amadurecimento quando gaseamento, como alta temperatura de maturação (68F) foi visto para produzir CO 2 níveis de 10% em 24 horas.
História de etileno em biologia vegetal
Etileno tem sido usado desde os antigos egípcios, que seria Gash figos, a fim de estimular o amadurecimento (ferimento estimula a produção de etileno por tecidos vegetais). Os antigos chineses iria queimar incenso em salas fechadas para melhorar o amadurecimento de peras. Em 1864, descobriu-se que vazamentos de gás de iluminação pública levou a desnutrição de crescimento, torção de plantas, e espessamento anormal das hastes. Em 1901, um cientista russo chamado Dimitry Neljubow mostrou que o componente ativo foi de etileno. Dúvida descoberto que o etileno estimulada abscission em 1917. Não foi até 1934 que Gane informou que as plantas sintetizar etileno. Em 1935, Crocker proposto que o etileno foi o hormônio vegetal responsável pela maturação dos frutos, bem como senescência de tecidos vegetativos.
Biossíntese de etileno em plantas
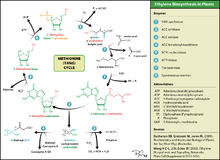
O etileno é produzido a partir de essencialmente todas as partes de plantas superiores, incluindo folhas, caules, raízes, flores, frutos, tubérculos, e plântulas.
"A produção de etileno é regulada por uma variedade de factores ambientais e de desenvolvimento. Durante a vida da planta, a produção de etileno é induzida durante determinadas fases do crescimento, tais como germinação, amadurecimento de frutas, abscisão de folhas, e senescência das flores. A produção de etileno pode também ser induzida por uma variedade de aspectos externos, tais como ferimento mecânico, stresses ambientais, e de certos produtos químicos, incluindo auxina e outros reguladores ".
O etileno é biossintetizados a partir do aminoácido metionina S -adenosyl- L metionina (SAM, também chamado AdoMet) pela enzima Met adenosiltransferase. SAM é então convertido 1-aminociclopropano-1-carboxílico (ACC) pela enzima ACC sintase (ACS). A actividade da ACS determina a taxa de produção de etileno, por conseguinte regulação desta enzima é essencial para a biossíntese de etileno. O passo final requer oxigénio e envolve a acção da enzima ACC-oxidase (ACO), anteriormente conhecido como o etileno formando enzima (EFE). Etileno biossíntese pode ser induzida por etileno endógeno ou exógeno. ACC síntese aumenta com altos níveis de auxinas, especialmente ácido acético indole (IAA) e citocininas. ACC sintase é inibida pela ácido abscísico.
Percepção de etileno em plantas
O etileno pode ser percebido por um transmembranar proteína complexo dímero. O gene que codifica um receptor de etileno foi clonado em Arabidopsis thaliana e, em seguida, em tomate. Receptores de etileno são codificadas por genes múltiplos no Arabidopsis e tomate genomas. O família de genes compreende cinco receptores em Arabidopsis e, pelo menos, seis no tomate, a maioria dos quais têm sido mostrados ligar-se ao etileno. de DNA para sequências de receptores de etileno também foram identificadas em muitas outras espécies de plantas e uma proteína de ligação de etileno tem ainda sido identificados em As cianobactérias.
Gatilhos ambientais e biológicas de etileno
Estímulos ambientais tais como fooding, seca, refrigeração, ferir, e ataque de patógenos pode induzir a formação de eteno nas plantas. Em inundações, raízes sofrem com a falta de oxigênio, ou anoxia, o que conduz à síntese de Ácido 1-aminociclopropano-1-carboxílico (ACC). ACC é transportado para cima na planta e, em seguida, oxidado em folhas. As causas de etileno produzido Nastić movimentos das folhas.
Respostas fisiológicas de plantas
Tal como as outras hormonas vegetais, o etileno é considerado como tendo efeitos pleiotrópicos. Isto significa essencialmente que pensa-se que pelo menos alguns dos efeitos da hormona são independentes. O que é realmente causada pelo gás pode depender do tecido afectado, bem como condições ambientais. Na evolução de plantas, etileno seria simplesmente uma mensagem que foi cooptado para usos não relacionados pelas plantas durante diferentes períodos do desenvolvimento evolutivo.
Lista de respostas das plantas ao etileno
- Plântula resposta triplo, espessamento e encurtamento de hipocótilo com gancho apical pronunciado.
- Em polinização, quando o pólen atinge o estigma, o precursor do etileno, ACC, é segregada para a pétala, o ACC libera etileno com ACC oxidase.
- Estimula a folha e flor senescência
- Estimula a senescência das maduro células do xilema em preparação para o uso de plantas
- Induz a folha abscisão
- Sementes induz germinação
- Induz o crescimento do cabelo da raiz - aumentando a eficiência da absorção de água e mineral
- Induz o crescimento de raízes adventícias durante inundações
- Estimula epinastia - folha pecíolo cresce fora, folha trava para baixo e cachos em si
- Estimula o amadurecimento de frutos
- Induz um aumento no climatério respiração em algumas frutas que provoca a liberação de etileno adicional.
- Afeta gravitropismo
- Estimula a flexão nutacional
- Inibe crescimento do caule e estimula caule e ampliação e crescimento das células ramo lateral fora da fase de plântula (veja Resposta Hyponastic)
- Interferência com transporte de auxina (com alta As concentrações de auxina)
- Inibe o crescimento de rebentos e fechamento dos estômatos, exceto em algumas plantas de água ou aqueles habitualmente inundadas como algumas variedades de arroz, onde ocorre o oposto (conservação de CO 2 e O 2)
- Induz a floração em abacaxis
- Inibe dia curto iniciação flor induzida em Pharbitus nulo e Crisântemo morifolium
Questões comerciais
Etileno encurta a vida útil de muitos frutos por apressando o amadurecimento dos frutos e floral senescência. Etileno vai encurtar a vida de prateleira de flores e vasos de plantas, acelerando senescência floral e floral abscission. Flores e plantas que são submetidos ao estresse durante o transporte, manuseio ou armazenamento de produtos de etileno causando uma redução significativa na exposição floral. Flores afectadas por etileno incluir cravo, gerânio, petúnia, levantou-se, e muitos outros.
O etileno pode causar perdas econômicas significativas para floristas, mercados, fornecedores e produtores. Os investigadores desenvolveram várias formas de inibir etileno, incluindo inibir a síntese de etileno e inibindo a percepção de etileno. Aminoetoxivinilglicina (AVG), Ácido aminooxiacético (AOA), e sais de prata são inibidores de etileno. Inibindo a síntese de etileno é menos eficaz para reduzir as perdas pós-colheita desde etileno a partir de outras fontes pode ainda ter um efeito. Ao inibir a percepção de etileno, frutas, plantas e flores não respondem ao etileno produzido endogenamente ou de fontes exógenas. Os inibidores da percepção de etileno incluem compostos que têm uma forma semelhante à de etileno, mas não provocam a resposta de etileno. Um exemplo de um inibidor de etileno é percepção 1-metilciclopropeno (1-MCP).
Produtores comerciais de bromélias, incluindo plantas de abacaxi, use etileno para induzir a floração. As plantas podem ser induzidas a flor ou por tratamento com o gás, numa câmara, ou por colocação de uma bananeira casca ao lado da planta de uma área fechada.
Crisântemo de florescência é adiada por gás etileno e produtores descobriram que o dióxido de carbono 'queimadores' e os gases de escape de aquecedores ineficientes estufa pode elevar a concentração de etileno para 0,05 vpm causando atraso na floração das culturas comerciais.
Ligand
O etileno é um ligando em química organometálica. Um dos primeiros compostos organometálicos, Sal de Zeise é um complexo de etileno. Os reagentes úteis incluem etileno que contêm Pt (PPh 3) 2 (C 2 H 4) e Rh 2 Cl 2 (C 2 H 4) 4. O Rh catalisada hidroformilação de etileno é realizada em escala industrial para fornecer propionaldeído.
História
Muitos geólogos e estudiosos acreditam que o famoso Oráculo grego em Delphi (o Pítia) entrou em seu estado de transe como um efeito de etileno passando de faltas à terra.
Etileno parece ter sido descoberto pela Johann Joachim Becher, que o obteve por aquecimento de etanol com ácido sulfúrico; ele mencionou o gás em seu Subterranea Physica (1669). Joseph Priestley também menciona o gás em seus experimentos e observações relativas aos vários ramos da filosofia natural: com a continuação das observações no ar (1779), onde ele relata que Jan Ingenhousz viu etileno sintetizado da mesma forma por um Sr. Enée em Amsterdã em 1777 e que posteriormente Ingenhousz produzido o próprio gás. As propriedades de etileno foram estudados em 1795 por quatro holandeses químicos, Johann Rudolph Deimann, Adrien Paets van Troostwyck, Anthoni Lauwerenburgh e Nicolas Bondt, que descobriram que ele diferia de hidrogênio do gás e que continha tanto carbono e hidrogênio. Este grupo também descobriu que o etileno pode ser combinado com cloro para produzir o óleo dos químicos holandeses, 1,2-dicloroetano; essa descoberta deu etileno o nome usado por ele na época, gás olefiant (gás de tomada de óleo.)
Em meados do século 19, o sufixo -eno (uma raiz grega antiga adicionada ao final de nomes femininos que significa "filha de") foi amplamente utilizado para se referir a uma molécula ou parte deste, que continha menos um átomos de hidrogênio do que a molécula sendo modificada. Assim, etileno (C 2 H 4) foi a "filha de acetato "(C 2 H 5). O nome de etileno foi usado neste sentido tão cedo como 1852.
Em 1866, o alemão químico August Wilhelm von Hofmann propôs um sistema de hidrocarboneto nomenclatura em que os sufixos -ano, -eno, -ine, -um, e -une foram usadas para designar os hidrocarbonetos com 0, 2, 4, 6 e 8 menos do que a sua hidrogênios pai alcano . Neste sistema, tornou-se etileno eteno. Sistema de Hofmann, eventualmente, se tornou a base para a nomenclatura de Genebra aprovadas pelo Congresso Internacional de Químicos em 1892, que continua a ser o cerne da Nomenclatura IUPAC. No entanto, por essa altura, o nome de etileno foi profundamente enraizada, e permanece em grande uso hoje, especialmente na indústria química.
Nomenclatura
As regras de nomenclatura IUPAC 1979 abriu uma exceção para reter o nome de etileno não-sistemática, no entanto, esta decisão foi revertida nas regras de 1993 para que o nome IUPAC é agora eteno.
Segurança
Como todos os hidrocarbonetos, o etileno é uma asfixiante e combustível. Ele tem sido usado como um anestésico. Ele está listada como um IARC classe 3 cancerígena.
