
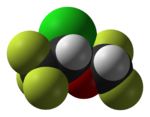
Flúor
Você sabia ...
Crianças SOS feita esta seleção Wikipedia ao lado de outras escolas recursos . Uma boa maneira de ajudar outras crianças é por patrocinar uma criança
| Flúor | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
9 F | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Aparência | ||||||||||||||||||||||||||||
| gás: amarelo muito claro líquido: amarelo brilhante sólida: transparente (beta), opaco (alpha)  Flúor líquido a temperaturas criogênicas | ||||||||||||||||||||||||||||
| Propriedades gerais | ||||||||||||||||||||||||||||
| Nome, símbolo, número | flúor, F, 9 | |||||||||||||||||||||||||||
| Pronúncia | / f l ʊər Eu n /, / f l ʊər ɪ n /, / f l ɔər Eu n / | |||||||||||||||||||||||||||
| Categoria elemento | halogéneo | |||||||||||||||||||||||||||
| Grupo, período, bloco | (17) átomos de halogénio , 2, p | |||||||||||||||||||||||||||
| Peso atômico padrão | 18.9984032 (5) | |||||||||||||||||||||||||||
| Configuração eletrônica | [Ele] 2s 2p 2 5 2, 7  | |||||||||||||||||||||||||||
| História | ||||||||||||||||||||||||||||
| Descoberta | André-Marie Ampère (1810) | |||||||||||||||||||||||||||
| Primeiro isolamento | Henri Moissan (26 de Junho, 1886) | |||||||||||||||||||||||||||
| Nomeado por | Humphry Davy | |||||||||||||||||||||||||||
| Propriedades físicas | ||||||||||||||||||||||||||||
| Fase | gás | |||||||||||||||||||||||||||
| Densidade | (0 ° C, 101,325 kPa) 1,696 g / L | |||||||||||||||||||||||||||
| Líquido densidade no pb | 1.505 g cm -3 · | |||||||||||||||||||||||||||
| Ponto de fusão | 53,53 K , -219,62 ° C, -363,32 ° F | |||||||||||||||||||||||||||
| Ponto de ebulição | 85,03 K, -188,12 ° C, -306,62 ° F | |||||||||||||||||||||||||||
| Ponto crítico | 144,4 K, 5,215 MPa | |||||||||||||||||||||||||||
| Calor de vaporização | 6,51 kJ mol -1 · | |||||||||||||||||||||||||||
| Capacidade calorífica molar | (C p) (21,1 ° C) 825 J · · mol -1 K -1 (V C) (21,1 ° C) 610 J · · mol -1 K -1 | |||||||||||||||||||||||||||
| Pressão de vapor | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||||||||||||
| Estados de oxidação | -1 (Oxida oxigénio) | |||||||||||||||||||||||||||
| Eletronegatividade | 3,98 (escala de Pauling) | |||||||||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 1.681 kJ · mol -1 | |||||||||||||||||||||||||||
| 2: 3374 kJ · mol -1 | ||||||||||||||||||||||||||||
| 3: 6147 kJ · mol -1 | ||||||||||||||||||||||||||||
| O raio de covalência | 64 pm | |||||||||||||||||||||||||||
| Van der Waals raio | 135 pm | |||||||||||||||||||||||||||
| Miscelânea | ||||||||||||||||||||||||||||
| A estrutura de cristal | cúbico 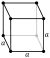 a estrutura refere-se a flúor sólido, logo abaixo do ponto de fusão, 1 atm | |||||||||||||||||||||||||||
| Ordenamento magnético | diamagnetic | |||||||||||||||||||||||||||
| Condutividade térmica | 0,02591 W · m -1 · K -1 | |||||||||||||||||||||||||||
| Número de registo CAS | 7782-41-4 | |||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | ||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de flúor | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Flúor (símbolo F) é o elemento químico com número atômico 9. É o mais leve halogéneo . Em pressão e temperatura padrão, flúor é um gás constituído por pálido amarelo moléculas diatômicas, F 2. O flúor é o mais elemento eletronegativo e é extremamente reativo, exigindo muito cuidado no manuseio. Tem um único estável isótopo , flúor-19.
Em estrelas, o flúor é rara em comparação com outros elementos leves. Na crosta da Terra, flúor é o elemento mais abundante XIII. Mais importante mineral de flúor, fluorite, foi primeiro descrita formalmente em 1530, no contexto de fundição. O nome do mineral deriva do verbo latino fluo, o que significa "fluxo", porque fluorite foi adicionado ao minérios metálicos para reduzir seus pontos de fusão. Sugerida como um elemento químico em 1811, flúor foi nomeado após o mineral de origem, mas resistiu muitas tentativas de isolar o elemento. Em 1886, o químico francês Henri Moissan sucedido. Seu método de electrólise continua a ser o método de produção industrial para gás de flúor. O principal uso do elemento flúor, enriquecimento de urânio, foi desenvolvido durante o Projeto Manhattan.
Devido à dificuldade em fazer flúor elementar, mais flúor usado no comércio nunca é convertido em flúor livre. Em vez disso, ácido fluorídrico é a tecla intermediário para a 16.000 milhões dólares por ano indústria fluorochemical global. O fluoretos de metais baixos praticados são compostos iónicos (sais); as de metais de alta cobradas são voláteis compostos moleculares . Os maiores utilizações de fluoretos inorgânicos são fabricação de aço e refinação de alumínio.
Compostos orgânicos de flúor tendem a ter elevada estabilidade química e térmica. O maior uso comercial está em gases refrigerantes (muitos tipos de "Freono"). Embora tradicional clorofluorocarbonetos são amplamente proibidos, os gases de substituição ainda contêm flúor. Politetrafluoroetileno (Teflon) é o mais importante fluoropolymer e é usado em isolamento elétrico, peças resistentes a produtos químicos, telhados estádio, e utensílios de cozinha. Uma fracção crescente de produtos farmacêuticos modernos contêm flúor; Lipitor e Prozac são exemplos proeminentes. Enquanto algumas plantas e bactérias sintetizam venenos organofluorine, flúor não tem um papel metabólico em mamíferos. O ião fluoreto, quando aplicada directamente aos dentes, reduz a cárie e por esse motivo é utilizada nas pastas de dentes e municipais fluoretação da água.
Características
Propriedades físicas
Formas de flúor diatómicas moléculas que são gasosos à temperatura ambiente. A densidade é cerca de 1,3 vezes a do ar. Embora às vezes citado como verde-amarelo, gás de flúor é realmente um muito amarelo pálido. A sua cor só pode ser observado no gás de flúor concentrado quando se olha a partir do eixo de tubos longos. Afigura-se transparente quando observada a partir do lado em tubos de vidro normais ou se escapem para a atmosfera. O elemento tem um odor característico "acre" que é notável em concentrações tão baixas como 20 ppb.
Flúor condensa em um líquido amarelo brilhante em -188 ° C (-307 ° F), perto das temperaturas de condensação de oxigênio e nitrogênio. Flúor solidifica a -220 ° C (-363 ° F) para uma estrutura cúbica, chamada beta-flúor. Esta fase é transparente e macio, com desordem significativa das moléculas. No -228 ° C (-378 ° F) de flúor sofre uma separação sólido-sólido transição de fase para uma estrutura monoclínica chamada alfa-flúor. Esta fase é opaco e rígido com camadas repleto de perto de moléculas. A mudança de fase de estado sólido requer mais energia do que a transição ponto de fusão e pode ser violento, quebrando amostras e soprando para fora das janelas porta-amostras. Em geral, no estado sólido de flúor é mais semelhante ao de oxigénio do que para os outros halogénios '.
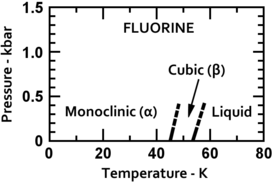 | 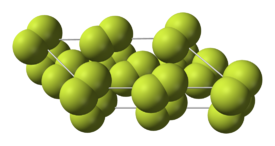 |
| Fases de flúor de baixa temperatura | Estrutura cristalina alfa-flúor |
Estrutura atômica
Um átomo de flúor tem nove prótons e nove elétrons , um a menos do que neon , dispostos no configuração eletrônica [Ele] 2s 2p 2 5. Electrões exteriores de flúor são relativamente separados uns dos outros, e, portanto, eles não protegem uns aos outros a partir do núcleo. Portanto, eles experimentam um alto carga nuclear eficaz. O flúor tem um relativamente pequeno raio covalente, ligeiramente menos do que 60 picometros, que é menos do que seus vizinhos, oxigênio e neon.
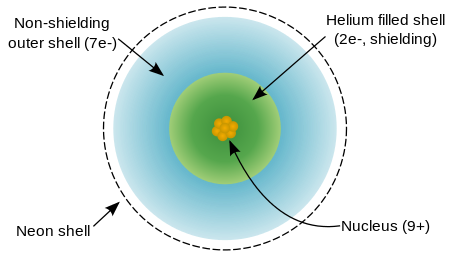
O flúor é relutante para ionizar e em vez disso tem uma atração para mais um elétron para atingir o arranjo neon-like extremamente estável. Flúor de primeira energia de ionização (energia necessária para remover um elétron para formar F +) é 1,681 quilojoules por mole, que é mais elevado do que para qualquer outro elemento com excepção de néon e hélio. Flúor de afinidade de electrões (energia libertada pela adição de um electrão para formar F -) é 328 kJ por mole, que é mais elevado do que o de qualquer outro elemento, excepto cloro.
Estrutura molecular
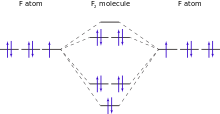
Apesar de um átomo de flúor indivíduo tem um electrão não emparelhado, em flúor molecular todos os elétrons estão emparelhados. Devido a isso, é flúor elementar diamagnetic (ligeiramente repelidos por ímãs). Em contraste, as moléculas de oxigénio elemento vizinho, com dois electrões desemparelhados por molécula, são paramagnética (atraída por ímãs). O valor medido de flúor de susceptibilidade magnética é -9,6 × 10 -6 (CGS), que está perto de previsões teóricas. O resultado experimental não foi conseguida até 1999 devido às dificuldades em lidar com gás de flúor, bem como a necessidade de purificar especialmente o flúor de qualquer traço de oxigênio paramagnético.
A ligação flúor-flúor da molécula difluorine é relativamente fraco quando comparado com a ligação dos outros halogéneos. A energia de ligação é significativamente mais fraca do que os de dichlorine ou dibromine moléculas e semelhante aos títulos de oxigênio de oxigênio facilmente clivada de peróxidos ou obrigações de nitrogênio em nitrogênio de hidrazinas. O raio covalente de flúor em moléculas difluorine, cerca de 71 picometros, é significativamente maior do que em outros compostos devido à fraca ligação entre átomos de flúor. Isso acontece porque o elétron e repulsas internucleares são relativamente grande, ea sobreposição orbital ligação é reduzida devido ao pequeno tamanho dos átomos.
2p elétrons de flúor são puramente 2p, ea molécula difluorine tem exatamente um vínculo (a ordem de ligação de exatamente 1). Em contraste, os níveis de p elétrons dos halogênios mais pesados hibridizam em parte com os de d elétrons. Isso faz com que se comportem, em parte, como d elétrons, e este personagem d parcial permite mostrar a ligação parcial entre elétrons d. Portanto, os halogéneos mais pesados tem um ordem de ligação efetivamente maior que 1; por exemplo, cloro tem uma ordem de ligação de 1,12. Elétrons de flúor não pode mostrar esse personagem d porque não existem d elétrons próximos em energia para flúor do 2p.
| X | X 2 | HX | BX 3 | AlX 3 | CX 4 |
|---|---|---|---|---|---|
| F | 159 | 574 | 645 | 582 | 456 |
| Cl | 243 | 428 | 444 | 427 | 327 |
| Br | 193 | 363 | 368 | 360 | 272 |
| EU | 151 | 294 | 272 | 285 | 239 |
Reatividade química
A química do flúor é dominado por sua tendência a ganhar um elétron. É o mais elemento electronegativo e um oxidante forte. A remoção de um elétron de um átomo de flúor requer tanta energia que não oxidante conhecido pode oxidar flúor para qualquer positivo estado de oxidação .
Reações com flúor são muitas vezes súbita ou explosivo. Muitas substâncias geralmente não reactivas, tais como o aço em pó, fragmentos de vidro e fibras de amianto são facilmente consumidos por gás de flúor frio. Wood e mesmo água queimar com chamas quando submetido a um jacto de flúor, sem a necessidade de uma faísca.
Flúor reagir com césio, vídeo pela Royal Institution. (Ambos os vídeos filmados em um laboratório de flúor, da Universidade de Leicester.) |
Compostos formas de flúor, fluoretos, com todos os elementos exceto néon e hélio . Todos os elementos até einsteinium , elemento 99, foram verificados, exceto para astatine e francium . O flúor é também conhecido para formar compostos com rutherfórdio , elemento 104, e seaborgio , elemento 106. Vários elementos pesados não radioactivos foram fluoretada devido à sua extrema raridade, mas tais reacções são teoricamente possíveis.
Todos os metais reagem com flúor, mas as condições variam com o metal. Muitas vezes, o metal deve ser pulverizado porque muitos metais passivar (formar camadas protetoras do fluoreto de metal que resistir mais a fluoretação). Os metais alcalinos reagem com flúor com um golpe (pequena explosão), enquanto os metais alcalino-terrosos reagem à temperatura ambiente, bem como, mas não agressiva. O metais nobres ruténio, ródio, paládio, platina, ouro e reagem menos facilmente, necessitando flúor gasoso puro, a 300-450 ° C (575-850 ° F).
Flúor reage explosivamente com hidrogénio de uma maneira semelhante à de metais alcalinos. Os halogênios reagem facilmente com gás de flúor como faz o pesado gás nobre radônio . Os gases nobres leves xénon e crípton pode ser feito reagir com o flúor sob condições especiais e com árgon irá combinar com fluoreto de hidrogénio. Azoto, com a sua muito estável ligações triplas, requer descarga elétrica e altas temperaturas para combinar diretamente com flúor.
Isótopos
Flúor ocorre naturalmente na Terra exclusivamente sob a forma de sua única estável isótopo , flúor-19, o que faz com que o elemento monoisotópico e mononuclidic. Dezessete radioisótopos foram sintetizados: números de massa 14-18 e 20-31. Flúor-18 é o radioisótopo mais estável de flúor, com uma meia-vida de 109,77 minutos. É também o mais leve nuclide instável com números ímpares iguais de prótons e nêutrons .
Os isótopos mais leves de flúor, aqueles com números de massa de 14-16, decadência via 17 de elétrons de captura. F e 18 F sofrer além de decaimento beta (por emissão de pósitrons). Todos os isótopos mais pesados do que o estável flúor-19 por decaimento Modo menos beta (emissão de electrões). Alguns deles também decair por emissão de nêutrons.
Apenas um isômero nuclear (estado nuclear animado de longa duração), flúor-18m, tem sido caracterizada. Sua meia-vida antes emissão de raios gama é de 160 nanossegundos. Isto é menos do que a semi-vida de decomposição de qualquer dos estados fundamentais de radioisótopos de flúor nuclear excepto números 14-16, 28 e 31.
Origem e ocorrência
No universo
| Atômico número | Elemento | Relativo quantidade |
|---|---|---|
| 6 | Carbono | 4800 |
| 7 | Azoto | 1500 |
| 8 | Oxigênio | 8800 |
| 9 | Flúor | 1 |
| 10 | Néon | 1400 |
| 11 | Sódio | 24 |
| 12 | Magnésio | 430 |
Do ponto de vista da cosmologia, flúor é relativamente raro, com 400 ppb no universo. Dentro de estrelas, flúor qualquer que seja criado é rapidamente eliminado através Fusão nuclear: ou com hidrogênio para formar oxigênio e hélio, ou com hélio para fazer neon e hidrogênio. A presença de flúor em tudo-fora de existência temporária em estrelas-é um mistério por causa da necessidade de se escapar destas reacções destruindo-flúor.
Existem três soluções teóricas para o mistério. Em supernovas do tipo II, átomos de neon são atingidos por neutrinos durante a explosão e convertido em flúor. Em Wolf-Rayet estrelas (estrelas azuis com mais de 40 vezes mais pesado do que o Sol), um forte vento solar sopra o flúor para fora da estrela antes hidrogénio ou hélio pode destruí-lo. Em filial gigante assintótica (um tipo de gigante vermelha) estrelas, reações de fusão ocorrem em pulsos e convecção levanta flúor para fora da estrela interna. Só a hipótese de gigante vermelha tem provas a partir de observações.
No espaço, flúor geralmente combina com hidrogénio para formar fluoreto de hidrogénio. (Este composto tem sido sugerido como um proxy para permitir detectar reservatórios de hidrogénio no universo.) Para além de HF, flúor monoatômico foi observada no meio interestelar. Flúor cátions têm sido vistos em nebulosas planetárias e nas estrelas, incluindo o nosso Sun.
Na Terra
O flúor é o décimo terceiro elemento mais comum na crosta terrestre, compreendendo entre 600 e 700 ppm da crosta em massa. Devido à sua reactividade, que é essencialmente apenas encontrada em compostos. Três minerais existentes que são fontes industrialmente relevantes: fluorite, fluorapatite, e cryolite.
- Fluorita (CaF 2), também chamado de fluorita ou Blue John, é a principal fonte de flúor comercial. Fluorita é um mineral colorido associado com depósitos hidrotermais. É comum e encontrada em todo o mundo. China fornece mais de metade da demanda do mundo; O México é o segundo maior produtor. Os Estados Unidos produziram mais de fluorita do mundo no início do século 20, mas a última mina, em Illinois, encerre em 1995.
- Fluorapatite (Ca 5 (PO 4) 3 F) é extraído juntamente com outros apatitas para a sua teor de fosfato e é utilizado principalmente para a produção de fertilizantes. Mais de flúor da terra é ligado neste mineral, mas porque a percentagem dentro do mineral é baixo (3,5%), o flúor é descartado como lixo. Só nos Estados Unidos há recuperação significativa. Lá, o hexafluorosilicates produzidos como subprodutos são utilizados para suprir a fluoretação da água municipal.
- Criolite (Na 3 AlF 6) é o menos abundante dos três, mas é uma fonte concentrada de flúor. Antigamente, era usado diretamente na produção de alumínio. No entanto, a principal mina comercial, na costa oeste da Groenlândia, fechado em 1987.
| Os principais minerais contendo flúor | ||
 |  |  |
| Fluorita | Fluorapatite | Criólito |
Vários outros minerais, tais como a pedra topázio, contém flúor. Fluoreto não é significativa na água do mar ou salmoura, ao contrário dos outros halogenetos, porque os fluoretos alcalinos terrosos precipitam da água.
Organofluorines têm sido observadas em erupções vulcânicas e fontes geotérmicas. Sua origem última é dito variar de formação física sob condições geológicas do início da produção biológica e deposição em sedimentos. No entanto, a proveniência está ainda a ser estudado, como é a distribuição organofluorine natural. Eles não são encontrados em grandes quantities (comparar também o número de organofluorines naturais conhecidas, a 30, para que de organoclorados, 2150), de modo que não estão comercialmente importante fonte de flúor.
A possibilidade de pequenas quantidades de flúor gasoso dentro de cristais tem sido debatida por muitos anos. Uma forma de fluorita, antozonite, tem um cheiro sugestivo de flúor quando esmagado. O mineral também tem uma cor escura, talvez a partir de cálcio livre (não ligado ao flúor). Em 2012, um estudo relatou a detecção de quantidades vestigiais (0,04% por peso), de flúor diatómico em antozonite. Foi sugerido que a radiação a partir de pequenas quantidades de urânio dentro dos cristais tinha causado o flúor livre defeitos.
História

A palavra "flúor" deriva da raiz latina da principal fonte mineral, fluorite, que foi mencionado pela primeira vez em 1529 por Georgius Agricola, que o descreveu como um um aditivo de fluxo, que ajuda a derreter e escórias minérios durante a fundição. Fluorita pedras foram chamados schone flusse nas alemão da época. Agricola, escrita em latim, mas descrevendo a indústria do século 16, inventou várias centenas de novos termos em latim. Para as pedras schone flusse, ele usou os FLUORES substantivo latino, "fluxos", porque eles fizeram minérios metálicos fluir quando em um incêndio. Depois Agricola, o nome para o mineral evoluíram para fluorita (ainda comumente utilizado) e, em seguida, a fluorita.
Algumas fontes afirmam que a primeira produção de ácido fluorídrico foi por Heinrich Schwanhard, um cortador de vidro alemão, em 1670. Um estudo peer-reviewed dos escritos de Schwanhard, porém, não mostrou nenhuma menção específica de discussão fluorite e só de um ácido extremamente forte. Postula-se que este foi, provavelmente, ácido nítrico ou água régia, ambos capazes de gravar vidro macio. Andreas Sigismund Marggraf fez a primeira preparação gravado de ácido fluorídrico em 1764 quando ele fluorite aquecida com ácido sulfúrico em vidro, o qual foi significativamente corroído pelo produto. Em 1771, o químico sueco Carl Wilhelm Scheele repetiu esta reacção. Scheele reconhecido o produto da reacção como um ácido, que ele chamou de "fluss-questiúnculas-syran" (fluor-espato-ácido); em Inglês, ele era conhecido como "ácido fluorídrico". Em 1810, o físico francês André-Marie Ampère sugerido que o ácido foi um composto de hidrogénio com um elemento desconhecido, de forma análoga ao cloro. Fluorite foi, em seguida, mostra-se na maior parte composta de fluoreto de cálcio.
Sir Humphry Davy originalmente sugeriu o nome de flúor, tomando a raiz do nome de "ácido fluorídrico" eo sufixo -ine, à semelhança de outros halogênios. Este nome, com modificações, veio a maioria dos idiomas europeus. (Em grego, russo, e vários outros idiomas usar o ftor nome ou derivados, o que foi sugerido por Ampère e vem do grego (φθόριος phthorios), que significa "destruidor".) O nome Nova Latina (fluorum) deu o seu símbolo elemento atual , F, embora o símbolo Fl é visto nos primeiros documentos. O símbolo Fl é agora usado para o elemento super-pesado fleróvio .
Devido à sua extrema reatividade, elemento flúor não foi isolado até muitos anos após a caracterização de fluorita. Progresso em isolar elemento flúor era lento porque a sua eletrolítica preparação foi difícil de executar e porque o gás reage com a maioria dos materiais. A geração de flúor elementar provou ser excepcionalmente perigosa, matando ou ofuscante vários experimentadores iniciais. Jean Dussaud refere a esses homens como "mártires de flúor", um termo usado ainda.
Edmond Frémy pensei que passagem de corrente elétrica através de ácido fluorídrico pura pode funcionar. Anteriormente, fluoreto de hidrogênio só estava disponível em uma solução de água. Portanto Frémy desenvolveu um método para a produção de fluoreto de hidrogénio seco por acidificação bifluoreto de potássio (KHF 2). Infelizmente, fluoreto de hidrogênio puro não passar uma corrente elétrica.

Químico francês Henri Moissan, anteriormente um dos alunos de Frémy, continuou a busca. Depois de tentar muitas abordagens diferentes, ele construiu em Frémy da tentativa anterior, combinando bifluoreto de potássio e fluoreto de hidrogênio. A solução resultante conduzida electricidade. Moissan também construiu equipamento especialmente resistente à corrosão: recipientes criados a partir de uma mistura de platina e irídio (quimicamente mais resistente do que a platina pura) com rolhas de fluorita. Após 74 anos de esforços por muitos químicos, em 26 de Junho 1886, Moissan relatou o isolamento de flúor elementar. O relatório do Moissan para a Academia Francesa de fazer flúor mostrou apreço pela façanha:
Um pode realmente fazer diversas hipóteses sobre a natureza do gás liberado; o mais simples seria a de que estamos na presença de flúor
Moissan depois inventou um aparelho mais barato para a tomada de flúor: Equipamento de cobre revestido com fluoreto de cobre. Em 1906, dois meses antes de sua morte, Moissan recebeu o Prêmio Nobel de Química por seu isolamento de flúor, bem como a invenção do forno elétrico a arco.
Durante os anos 1930 e 1940, as Empresa DuPont comercializada compostos organofluorine em grandes escalas. Após testes de clorofluorocarbonetos como refrigerantes por pesquisadores General Motors, DuPont desenvolvido produção em larga escala de Freon-12. DuPont ea GM formou uma joint venture em 1930 para comercializar o novo produto; em 1949, a DuPont assumiu o negócio. Freon provou ser um sucesso de mercado, rapidamente substituindo anteriormente, mais tóxica, refrigerantes e crescente no mercado global para frigoríficos de cozinha.
Em 1938, politetrafluoretileno (Teflon) foi descoberto por acaso por um PhD DuPont recém-contratado, Roy J. Plunkett. Ao trabalhar com um cilindro de tetrafluoroetileno, ele foi incapaz de liberar o gás, embora o peso não mudou. Raspando o recipiente, ele encontrou flocos brancos de um polímero novo para o mundo. Os testes mostraram que a substância era resistente à corrosão da maior parte das substâncias e tinha uma melhor estabilidade a altas temperaturas do que qualquer outro plástico. No início de 1941, um programa de choque estava fazendo quantidades comerciais.

Produções em grande escala de flúor elementar começou durante a Segunda Guerra Mundial. Alemanha usou a alta temperatura de eletrólise para produzir toneladas de trifluoreto de cloro, um composto planeado para ser usado como um incendiária. O Projecto Manhattan nos Estados Unidos produziram mais de flúor para uso em separação de urânio. Gasoso hexafluoreto de urânio foi usada para separar urânio-235, uma importante nuclear explosivo, do mais pesado urânio-238 em centrífugas e plantas de difusão. Porque hexafluoreto de urânio libera pequenas quantidades de flúor corrosivo, as plantas de separação foram construídas com materiais especiais. Todos os tubos foram revestidas com níquel; articulações e partes flexíveis foram fabricadas a partir de Teflon.
Em 1958, um gerente de pesquisas da DuPont no negócio de Teflon, Bill Gore, deixou a empresa por causa de sua unwillingess para desenvolver Teflon como isolamento de fios de revestimento. O filho de Gore Robert encontrado um método para resolver o problema do fio de revestimento e a empresa WL Gore and Associates nasceu. Em 1969, Robert Gore desenvolveu uma membrana de PTFE expandido que levou à grande Negócio Gore-tex em impermeáveis respirável. A empresa desenvolveu muitos outros usos de PTFE.
Em 1970 e 1980, as preocupações sobre o papel desenvolvido clorofluorocarbonos jogar em danificar o camada de ozônio. Por volta de 1996, quase todas as nações havia proibido refrigerantes clorofluorocarbonados e produção comercial cessou. Flúor continuou a desempenhar um papel na refrigeração embora: hidroclorofluorcarbonos (HCFC) e hidrofluorocarbonetos (HFC) foram desenvolvidos como refrigerantes de substituição.
Indústria e aplicações
O mercado global de produtos químicos fluorados foi US $ 16 bilhões por ano a partir de 2006. Historicamente, a indústria cresceu uns poucos por cento por ano e está previsto para fazê-lo no futuro. Embora a demanda fluorochemical contraída durante a recessão global de 2008-2009, a indústria foi previsto para atingir 2,6 milhões de toneladas por ano até 2015.
O maior mercado é os Estados Unidos. A Europa Ocidental é a segunda maior. Ásia-Pacífico é a região de maior crescimento da produção. China, em particular, tem experimentado um crescimento significativo como um mercado de produto químico fluorado e está se tornando um produtor de-los também.
Mineração de fluorita (a principal fonte de flúor) foi estimado em 2003 para ser uma indústria de US $ 550 milhões, extraindo 4,5 milhões de toneladas por ano. A maior parte dos minérios devem ser tratados para concentrar o fluoreto de outros sais minerais através de vários métodos de separação por flutuação. No entanto, apenas cerca de 1% de fluorite extraído é já convertido em flúor elementar.
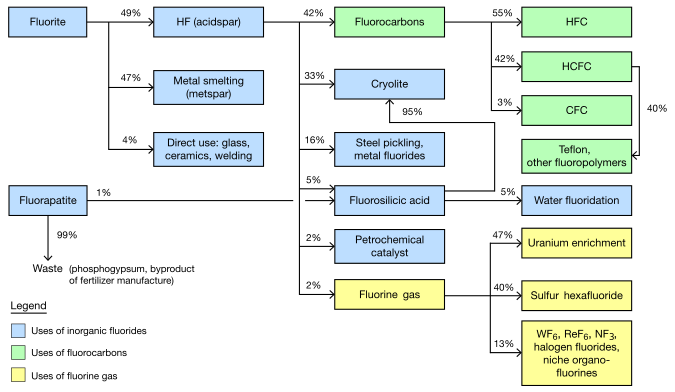
Fluoretos inorgânicos
Fluorite extraído é separado em dois tipos principais, com aproximadamente a mesma produção de cada Acidspar é, pelo menos, 97% de CaF2;. Metspar é muito mais baixa pureza, 60-85%. (Uma pequena quantidade do intermediário, de cerâmica, de grau também é feita.)
Metspar é usado quase exclusivamente para a fundição de ferro. Acidspar é primeiramente convertido em ácido fluorídrico (por reacção com ácido sulfúrico). O HF resultante é usado principalmente para produzir organofluorides e criolita sintética.
Cerca de 3 kg (6,5 lb) de fluoreto de grau metspar, adicionado directamente ao lote, são utilizados para cada tonelada de aço feitas. Os íons de flúor de CaF2 menor temperatura do derretimento e viscosidade (fazer o runnier líquido). O teor de cálcio tem um benefício tangencial na remoção de enxofre e de fósforo, mas outros aditivos tais como cal ainda são necessários. Metspar semelhante é usado na produção de ferro fundido e de outras ligas contendo ferro.
Fluorite do grau acidspar é utilizado directamente como um aditivo para cerâmicas e esmaltes, fibras de vidro e vidro e nublado, cimento, assim como no revestimento exterior de hastes de soldadura. Acidspar é usada principalmente para preparar o ácido fluorídrico, o que é um intermediário químico para a maioria dos compostos contendo flúor. Usos significativos diretos de HF incluem decapagem (limpeza) de aço, craqueamento de alcanos na indústria petroquímica, e gravura de vidro.
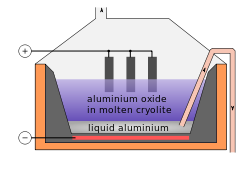
Um terço de HF (um sexto de flúor minado) é usado para fazer criolite sintética ( hexafluoroaluminate de sódio) e trifluoreto de alumínio. Estes compostos são utilizados na electrólise de alumínio. Cerca de 23 kg (51 lb) são necessárias para cada tonelada de alumínio. Estes compostos são também utilizados como um fluxo para o vidro.
Fluorossilicatos são os próximos fluoretos inorgânicos mais significativos formados a partir de HF. A mais comum, que de sódio, é usado para a fluoretação da água, como um intermediário sintético para criolite e tetrafluoreto de silício, e para o tratamento de efluentes em lavandarias.
MgF 2 e, em menor grau, outras difluorides alcalino-terrosos são materiais ópticos especiais. Difluoreto de magnésio é amplamente usado como um revestimento anti-reflexo para lentes e equipamentos ópticos. O composto é também um componente de construções concebidas recentemente ( metamateriais índices negativos) que são objecto de investigação "invisibilidade". As estruturas em camadas pode curva de luz em torno dos objetos.
Outros fluoretos inorgânicos feitos em grandes quantidades incluem difluoreto de cobalto (por síntese organofluorine), difluoreto de níquel (electrónica), fluoreto de lítio (um fluxo), o fluoreto de sódio (fluoretação água), fluoreto de potássio (fluxo), e fluoreto de amónio (vários). De sódio e de potássio bifluoretos são significativos para a indústria química.
Fluorcarbonos
Fazendo fluoretos orgânicos é o principal uso para o ácido fluorídrico, consumindo mais de 40% do mesmo (mais de 20% de toda a fluorita minado). Dentro organofluorides, gases refrigerantes ainda são o segmento dominante, consumindo cerca de 80% de HF. Mesmo que os clorofluorocarbonetos são amplamente proibidos, os refrigerantes de substituição são muitas vezes outras moléculas fluorados. Polímeros fluorados são menos de um quarto do tamanho de gases refrigerantes em termos de uso de flúor, mas estão crescendo mais rapidamente. Fluorotensioactivos são um pequeno segmento em massa, mas são significativas economicamente por causa dos preços muito elevados.
Gases refrigerantes
Cultura clorofluorocarbonetos (CFC) eram o produto químico fluorado orgânico predominante. Os CFCs são identificados por um sistema de numeração que explica a quantidade de flúor, de cloro, de carbono e de hidrogénio nas moléculas. O termo Freon foi coloquialmente usada para CFCs e moléculas halogenados semelhantes, embora estritamente falando, isso é apenas uma marca DuPont, e existem muitos outros produtores. Terminologia neutra marca é usar o "R" como o prefixo. CFCs proeminentes incluídos R-11 ( triclorofluorometano), o R-12 ( diclorodifluorometano), e R-114 ( 1,2-diclorotetrafluoroetano).

A produção de CFCs cresceu fortemente durante os anos 1980, principalmente para refrigeração e ar condicionado, mas também para propulsores e solventes. Uma vez que a utilização final desses materiais é proibido na maioria dos países, esta indústria encolheu drasticamente. No início do século 21, a produção de CFCs foi inferior a 10% do pico de meados da década de 1980, com o restante da utilização principalmente como um intermediário para outros produtos químicos. A proibição dos CFC inicialmente deprimido a procura global para a produção de fluorita, mas do século 21 do mineral fonte recuperou para níveis de 1980.
Hidroclorofluorcarbonos (HCFC) e os hidrofluorcarbonos (HFCs) agora servem como substitutos para refrigerantes CFC; poucos foram fabricados comercialmente antes de 1990. Actualmente, mais de 90% de flúor usado para orgânicos vai para estas duas classes (em quantidades aproximadamente iguais). HCFCs proeminentes incluem R-22 ( clorodifluorometano) e R-141b ( 1,1-dicloro-1-fluoroetano). O principal é HFC R-134a ( 1,1,1,2-tetrafluoroetano).
A bromofluoroalkane ", Halon" ( bromotrifluormetano) ainda é largamente utilizado em navios e aviões sistemas antiincêndio gasosos. Porque a produção Halon foi proibida desde 1994, os sistemas são dependentes das lojas pré-ban e na reciclagem.
Fluoropolymers
Os polímeros fluorados são menos do que 0,1% de todos os polímeros produzidos, em termos de peso. Eles são mais caros e têm taxas de crescimento mais elevadas do que os polímeros médios. A partir de cerca de 2006-2007, as estimativas da produção mundial fluoropolymer variou de mais de 100.000 para 180.000 toneladas métricas por ano. As estimativas de receitas anuais variaram de mais de US $ 2,5 bilhões para mais de US $ 3,5 bilhões.
PTFE (politetrafluoretileno) é de 60-80% da produção de fluoropolímero o mundo numa base de peso. O termo Teflon é por vezes utilizado genericamente para a substância, mas é existir uma marca DuPont produtores de PTFE-nome dos outros e, por vezes, a DuPont utiliza a marca Teflon para outros materiais. PTFE recebe o flúor sem a necessidade de gás de flúor: clorofórmio (triclorometano) é tratada com HF para tornar clorodifluorometano (R-22, um HFC); quando este produto químico marcas aquecidas tetrafluoroetileno (TFE abreviado), o ponto de partida para PTFE.
O maior pedido de PTFE está em isolação elétrica. É uma excelente dieléctrica e muito quimicamente estável. Ele também é usado extensivamente na indústria de processo químico em que é necessária resistência à corrosão: em tubos de revestimento, na tubulação, e juntas. Outro uso importante é arquitetônico tecido (PTFE revestido de pano de fibra de vidro usado para telhados estádio e tal). A principal aplicação do consumidor é panelas antiaderentes.
| As principais aplicações de PTFE | ||
 |  |  |
| PTFE dielétrico que separa core e metal externo em um cabo coaxial especialidade | Primeiro Teflon marca frigideira de 1961 | O interior da Tokyo Dome. O telhado é de fibra de vidro revestidos com PTFE e apoiou-ar. |
Quando esticado com um empurrão, filmes de PTFE faz uma multa de poros membrana: PTFE expandido ( ePTFE). O termo "Gore-tex" às vezes é usado genericamente para este material, mas que é um nome de marca específica. WL Gore não é a única produtora de ePTFE e, além disso, "Gore-tex", muitas vezes refere-se a mais complicada membranas multi-camada ou tecidos laminados. ePTFE é utilizado em vestuário para a chuva, vestuário de proteção e líquidos e filtros de gás.PTFE também pode ser formado emfibras que são usados naembalagem da bomba (selos) efiltros de saco de casas para indústrias com escapamentos corrosivos.
Outros fluoropolímeros tendem a ter propriedades semelhantes a resistência química de PTFE de alta e boas propriedades dieléctricas-que leva a utilizar na indústria de processos químicos e de isolamento eléctrico. Eles são mais fáceis de trabalhar com (a moldar em formatos complexos), mas são mais caros do que o PTFE e tem menor estabilidade térmica. etileno propileno fluorado (FEP), é a segunda mais fluoropolímero produzido. Filmes de dois polímeros fluorados diferentes servir como vidro-substituições em células solares.

Fluorados ionomers são materiais caros, resistente a produtos químicos usados como membranas de certas células eletroquímicas. Nafion, desenvolvidos na década de 1960, foi o primeiro exemplo e continua a ser o material mais proeminente na classe. O pedido inicial foi Nafion como um material de célula de combustível na nave espacial. Desde então, o material vem transformando a 55 milhões de toneladas por ano a indústria alcalinos; que está substituindo as células à base de mercúrio perigosos com células da membrana que são também mais eficiente da energia. Enquanto as plantas de tecnologia mais velhos continuam a correr, novas usinas normalmente usam células da membrana. Em 2002, mais de um terço da capacidade global para a indústria foi de célula de membrana com base. Recentemente, a aplicação de células de combustível ressurgiu; pesquisa significativa está sendo realizado e os investimentos feitos relacionado para obter células da membrana de troca de prótons (PEM) de combustível em veículos.
Fluoroelastomers são substâncias semelhantes a borracha que são compostos de misturas de polímeros de flúor reticulados. Viton é um exemplo proeminente. Resistentes a produtos químicos O-rings são a aplicação primária. Os fluoroelastómeros tendem a ser mais duro do que os elastómeros convencionais, mas com resistência ao calor e química superior.
Surfactantes

Surfactantes fluorados são pequenas moléculas organofluorine, principalmente utilizados em DWR (água durável repelente). Fluorotensioactivos formam um grande mercado, mais de US $ 1 bilhão por ano a partir de 2006. Scotchgard é uma marca de destaque, com receita de mais de US $ 300 milhões em 2000. fluorotensioactivos são produtos químicos caros, comparável a produtos químicos farmacêuticos: $ 200-2000 por quilograma ($ 90-900 por libra ).
Fluorotensioactivos fazer uma muito pequena parte do mercado de surfactante total, a maioria dos quais é à base de hidrocarbonetos e muito mais barato. Algumas aplicações potenciais (por exemplo, tintas de baixo custo) são incapazes de usar fluorotensioactivos por causa do impacto de preços de composição no mesmo pequenas quantidades de fluorotensioactivo. Utilização em tintas foi de apenas US $ 100 milhões a partir de 2006.
DWR é um revestimento (camada muito fina) colocar em tecidos que torna levemente chuva resistente, que faz talão de água. Desenvolvido pela primeira vez na década de 1950, fluorotensioactivos foram de 90% da indústria de DWR em 1990. DWR é usado com tecidos de vestuário, carpetes e embalagens de alimentos. DWR é aplicada a tecidos por "dip-squeeze seca" (imersão em banho DWR-água, pressionando a água para fora, e, em seguida, secagem).
Gás de flúor
Para os países com dados disponíveis (países de livre mercado), cerca de 17.000 toneladas métricas de flúor são produzidos por ano por 11 empresas, todas G7 residente. O flúor é relativamente barato, custando cerca de US $ 5-8 por quilograma (US $ 2-4 por libra) quando vendido como hexafluoreto de urânio ou hexafluoreto de enxofre. Devido a dificuldades de armazenamento e manuseio, o preço do gás de flúor puro é muito maior. Processos de grandes quantidades de gás de flúor exigentes geralmente integrar verticalmente e produzir o gás no local para uso direto.
A maior aplicação para flúor elementar é a preparação de hexafluoreto de urânio, que é usado na produção de combustíveis nucleares. Para se obter o composto, o dióxido de urânio é tratado primeiro com ácido fluorídrico, para produzir o tetrafluoreto de urânio. Este composto é então fluorado por exposição directa ao flúor gás para fazer o hexafluoreto. Monoisotópico ocorrência natural do flúor torna útil no enriquecimento de urânio, porque as moléculas de hexafluoreto de urânio será diferente em massa apenas por causa de diferenças de massa entre o urânio-235 e urânio-238. Estas diferenças de massa são usados para separar o urânio-235 e urânio-238 por meio de difusão e centrifugação. Até 7.000 toneladas por ano de gás de flúor são utilizados para esta aplicação.

A segunda maior aplicação para o gás de flúor é o hexafluoreto de enxofre, o qual é utilizado como um meio dieléctrico, em estações de comutação de alta tensão. SF 6 gás tem uma força dieléctrica muito mais elevada do que o ar. É extremamente inerte e, em comparação com distribuidora cheia com óleo, não tem PCB (um produto químico perigoso). Hexafluoreto de enxofre também é usado em janelas com isolamento acústico, na indústria de eletrônicos, bem como aplicações médicas e militares de nicho. O composto pode ser feita sem o uso de gás de flúor, mas a reacção entre o enxofre puro e gás de flúor puro, desenvolvido pela primeira vez por Moissan, continua a ser a prática comercial. Cerca de 6.000 toneladas por ano de gás de flúor são consumidos.
Vários compostos fabricados a partir de flúor elementar servir a indústria eletrônica. Rênio e tungstênio hexafluorides são utilizados para deposição de vapor químico de filmes de metal finos, em semicondutores. Tetrafluoromethane, é utilizado para a corrosão por plasma em semicondutores de fabricação, produção monitor de tela plana, e sistemas microeletromecânicos fabricação. trifluoreto de nitrogênio é cada vez mais utilizada para limpeza de equipamentos em fábricas de exibição . Flúor elementar, em si, é por vezes utilizado para limpeza do equipamento.
Para fazer organofluorines de nicho e produtos farmacêuticos contendo flúor, fluoração direta é geralmente muito difícil de controlar. Preparação de fluorinators força intermediários de gás de flúor resolve este problema. O halogéneo fluoretos ClF 3 , BrF 3 , e se 5 fornecer fluoração suave, com uma série de vantagens. Eles também são mais fáceis de manusear. Tetrafluoreto de enxofre é usado em particular para fazer pharmacueticals fluorados.
Estados Unidos e cientistas espaciais soviéticas no início dos anos 1960 estudou flúor elementar como um possível propulsor do foguete devido à maior impulso específico gerado quando flúor substituído oxigênio em combustão. Os experimentos falhou porque flúor provou difícil de manusear, e o seu produto de combustão (normalmente fluoreto de hidrogénio) foi extremamente tóxico e corrosivo.
Produção de gás de flúor

Produtores comerciais de gás de flúor continuar a usar o método da eletrólise pioneiro Moissan, com algumas modificações no design da célula. Devido a corrosividade do gás, materiais de contenção e precauções especiais de manuseio são necessários. Rotas químicas para a forma elementar foram publicados em 1986.
Síntese eletrolítico
Vários milhares de toneladas de flúor elementar são produzidos anualmente por electrólise de bifluoreto de potássio em ácido fluorídrico. Formas bifluoreto de potássio espontaneamente a partir de fluoreto de potássio e fluoreto de hidrogénio:
- HF + KF → KHF2
Fluoreto não é considerado um elemento mineral essencial para os mamíferos e seres humanos. Pequenas quantidades de fluoreto pode ser benéfica para a resistência óssea, mas este é um problema apenas na formulação de dietas artificiais. Comida e água potável tipicamente contêm pelo menos pequenas quantidades de fluoretos, que estão naturalmente presentes.
Vários outros aspectos biológicos de flúor existe. O flúor é amplamente utilizado para a prevenção de cáries dentárias. Nos produtos farmacêuticos e agrotóxicos, flúor vê crescente utilização de novas moléculas. Venenos que contêm flúor são bem conhecidos por matar insetos e roedores e os muito poucos organismos que incorporam flúor em sua bioquímica que façam venenos naturais. Ambos isótopos radioativos de flúor e naturais são importantes em seus respectivos aplicativos de digitalização. Perfluorcarbonos de transporte de oxigênio apresentar uma possibilidade para o ser humano respiração de líquido.
Cuidado dental
Íons de flúor em contato com os dentes têm sido pensado para limitar cavidades rodando o formando a hidroxiapatita de dentes em menos fluorapatite solúvel. Os mais up-to-date estudos mostram nenhuma diferença em níveis de cárie entre dentes com esmalte fluoretada em diferentes graus, enquanto baixos níveis de flúor na saliva e fluido da placa definitivamente ajudam a combater os primeiros cárie. O processo de absorção de fluoreto funciona apenas por contato direto ( tratamento tópico). Íons de flúor que são engolidas não beneficiam os dentes.
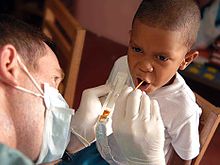
A fluoretação da água é a adição controlada de flúor para um abastecimento público de água para reduzir a cárie dentária. A sua utilização começou na década de 1940, na sequência de estudos de crianças em uma região onde a água é naturalmente fluoretada. Agora, é usado por cerca de dois terços da população dos Estados Unidos sobre os sistemas públicos de água e para cerca de 5,7% das pessoas em todo o mundo. Embora a melhor evidência disponível mostra nenhuma associação com outros de fluorose (dentários e, nos piores casos, esqueléticos) efeitos adversos, a maioria dos quais é leve, a fluoretação da água tem sido controversa por ética, segurança e razões de eficácia, e oposição a fluoretação da água existe apesar de seu apoio por organizações de saúde pública. Os benefícios da fluoretação da água tem diminuído recentemente, presumivelmente por causa da disponibilidade de flúor em outras formas, mas ainda são mensuráveis, em especial para grupos de baixa renda. As revisões sistemáticas em 2000 e 2007, mostrou redução significativa de cáries em crianças associadas com a fluoretação da água.
O fluoreto de sódio, difluoreto de estanho, e, mais geralmente, o monofluorofosfato de sódio, são utilizados em creme dental. Em 1955, a primeira pasta de dentes fluoreto foi introduzida, nos Estados Unidos. Agora, quase todos creme dental em países desenvolvidos é fluoretada. Por exemplo, 95% de pasta de dentes Europeia contém flúor. Géis e espumas são frequentemente aconselhados para grupos de pacientes especiais, especialmente aqueles submetidos a terapia de radiação para a cabeça (pacientes com câncer). O doente recebe uma aplicação de uma grande quantidade de fluoreto de quatro minutos. Existem vernizes que desempenham uma função similar, mas são mais rapidamente aplicadas. O flúor também está contido em prescrição e não sujeitos a receita bochechos e é um componente de rastreamento de alimentos provenientes de abastecimento de água fluoretada.
Pharmaceuticals
Vários fármacos importantes contêm flúor. De medicamentos comercializados, já 20% contêm flúor, como até mesmo um único átomo de que melhora a reactividade química da molécula do fármaco utilizado.
Por causa da estabilidade considerável da ligação de carbono-flúor, muitos medicamentos são fluorado para atrasar a sua metabolismo (transformando-se em uma outra molécula, o processo químico por trás disto é como as drogas funcionam). Isso prolonga as suas meias-vidas e permite longos tempos entre a dosagem e a activação. Por exemplo, uma anel aromático pode adicionar para evitar o metabolismo de um fármaco, mas isto apresenta um problema de segurança, porque alguns compostos aromáticos são metabolizados no corpo em venenosos epóxidos pelo organismo de nativo enzimas. Substituindo por um átomo de flúor em um parágrafo posição, no entanto, protege o anel aromático e impede que o epóxido de ser produzido.
A adição de flúor para orgânicos biologicamente activos aumenta a sua lipofilicidade (capacidade de se dissolver em gorduras), porque a ligação de carbono-flúor é ainda mais hidrofóbico do que a ligação carbono-hidrogénio. Este efeito aumenta frequentemente uma droga biodisponibilidade devido ao aumento da penetração da membrana celular. Embora o potencial do flúor para ser lançado como um fluoreto de grupo de saída depende da sua posição na molécula, organofluorides são geralmente muito estável, uma vez que a ligação carbono-flúor é forte.
Flúores também encontrar as suas utilizações em comum mineralocorticóides, uma classe de drogas que aumentam a pressão sanguínea . Adicionando um átomo de flúor aumenta tanto o seu poder médico e efeitos anti-inflamatórios. Contendo flúor fludrocortisona é uma das mais comuns tais drogas. dexametasona e a triancinolona, que estão entre os mais potentes do sintéticos relacionados com corticosteróides classe de drogas, bem contêm flúor.
Vários gerais inalatóriosagentes anestésicos, incluindo os agentes inalatórios mais comumente utilizados, também contêm flúor. Exemplos incluem sevoflurano,desflurano eisoflurano, que sãoderivados de hidrofluorocarbonetos.
Muitos Antidepressivos ISRS são orgânicos fluorados, incluindocitalopram,escitalopram, efluoxetina.fluoroquinolonas são uma família comumente usado deantibióticos de amplo espectro.
 |  |  |  |
|---|---|---|---|
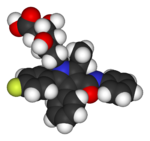
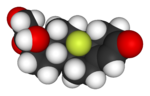
| Lipitor (atorvastatina) | 5-FU (Fluorouracilo) | Florinef (fludrocortisone) | Isoflurano |
Agrotóxicos e venenos naturais

Estima-se que 30% dos compostos agroquímicas contêm flúor. A maioria deles são venenos, mas alguns estimular o crescimento em vez disso. A posterior utilização agrotóxicos flúor é dito que confiar em melhoria da reação de síntese (redução dos custos levantados pelo teor de flúor) e nível de verde consideração química (fluorochemicals são mais respeitadores do ambiente).
Sintético fluoroacetato de sódio foi usado como um insecticida, mas é especialmente eficaz contra pragas de mamífero. O nome "1080" refere-se ao número de catálogo do veneno, que se tornou sua marca. Fluoroacetato é semelhante ao acetato, que tem um papel central no ciclo de Krebs (a parte fundamental do metabolismo celular). Fluoroacetato interrompe o ciclo e faz com que as células sejam privadas de energia. Vários outros insecticidas conter fluoreto de sódio, que é muito menos tóxico do que o fluoroacetato. Atualmente, o composto é proibido. Outra agrichemcial importante é Trifluralin. Era uma vez muito importante (por exemplo, em 1998 mais de metade da área do campo de algodão dos EUA foi revestida com o produto químico); no entanto, suas suspeitas propriedades cancerígenas causado alguns países do Norte da Europa para proibi-lo em 1993. Atualmente, toda a União Europeia proibiu, embora tenha havido um caso destina-se a cancelar a decisão.
Os agroquímicos usados atualmente utilizam uma outra tática: Em vez de ser venenoso si mesmos, eles penetram no metabolismo não afetá-lo diretamente, mas para se transformar em compostos realmente venenosas. Por exemplo, insectos alimentadas 29-fluorostigmasterol produzir os fluoroacetates a partir dele. Se um átomo de flúor é transferida para uma célula do corpo, ele bloqueia o metabolismo na posição ocupada.
Organofluorines biologicamente sintetizados foram encontrados em microrganismos e plantas, mas não em animais. O exemplo mais comum é fluoroacetato, com uma molécula de veneno ativo idêntico ao comercial "1080". É usado como um defesa contra herbívoros por pelo menos 40 plantas verdes na Austrália, Brasil e África; outros organofluorines sintetizados biologicamente incluem ω-fluoro ácidos gordos , fluoroacetone, e 2-fluorocitrate. Em bactérias, o enzima adenosil-flúor-sintase, o que faz com que a ligação carbono-flúor, foi isolado. A descoberta foi apontado como possivelmente levando a rotas biológicas para a síntese organofluorine.
Exploração

Os compostos contendo flúor-18, um isótopo radioactivo que emite positrões, são muitas vezes utilizados em tomografia por emissão de positrões de varredura (PET), porque meia-vida do isótopo de cerca de 110 minutos é muito pelos padrões de positrões-emissor. Um tal radiofármaco é 2-desoxi-2- ( 18 F) fluoro-D-glucose (genericamente referido como fluodesoxiglucose), vulgarmente abreviado como 18 F-FDG, ou simplesmente FDG. Em imagiologia de PET, FDG pode ser usado para asessing metabolismo da glucose no cérebro e para imagiologia de tumores de cancro. Após a injecção no sangue, FDG é retomado por "tecidos de FDG-ávidos" com uma elevada necessidade de glucose, tais como o cérebro e a maioria dos tipos de tumores malignos. Tomografia, frequentemente assistida por um computador, para formar um PET / CT (CT significa) máquina "tomografia computadorizada", pode então ser usada para diagnosticar ou monitorar o tratamento de cancros; especialmente linfoma de Hodgkin, câncer de pulmão e câncer de mama.
Flúor natural é monoisotópico, consistindo apenas de flúor-19. Os compostos de flúor são altamente passível de ressonância magnética nuclear (RMN), flúor-19, porque tem um spin nuclear de ½, um elevado momento magnético nuclear, e uma alta proporção magnetogyric. Os compostos de flúor têm tipicamente um rápido RMN relaxamento, que permite a utilização de uma média rápida para se obter uma relação sinal-para-ruído semelhante ao espectro de hidrogénio RMN-1. Flúor-19 é comumente utilizado em estudo de RMN de metabolismo, estruturas de proteínas e mudanças de conformação. Além disso, os gases fluorados inertes têm o potencial de ser uma ferramenta barata e eficiente para a ventilação do pulmão de imagem.
Pesquisa transporte de oxigênio
Fluorocarbonos líquidos têm uma capacidade muito elevada para a realização de gás em solução. Eles podem segurar mais oxigênio ou dióxido de carbono do que o sangue faz. Por essa razão, eles têm atraído o interesse em curso relacionados com a possibilidade de sangue artificial ou de respiração de líquido.

Substitutos do sangue são objecto de investigação porque a demanda por transfusões de sangue cresce mais rápido do que doações. Em alguns cenários, sangue artificial pode ser mais conveniente ou seguro. Como fluorocarbonetos normalmente não se misturam com água, eles devem ser misturados em emulsões (pequenas gotículas de perfluorocarbono suspenso em água) a ser utilizado como o sangue. Um desses produtos, Oxycyte, tem sido através de ensaios clínicos iniciais.
Possíveis usos médicos de respiração líquida (que utiliza líquido perflurocarbon puro, não uma emulsão de água) envolvem assistência para bebês prematuros ou de vítimas de queimaduras (porque a função pulmonar normal é comprometida). Tanto o enchimento parcial dos pulmões e o enchimento completo dos pulmões têm sido considerados, embora apenas o primeiro tem quaisquer ensaios significativos em seres humanos. Vários testes em animais foram realizados e alguns ensaios de ventilação líquida parcial humanos. Um esforço, por Alliance Pharmaceuticals, chegou a ensaios clínicos, mas foi abandonado por causa da vantagem insuficiente em comparação com outras terapias.
Nanocristais representam um possível método de entrega de drogas solúveis em água ou gordura dentro de um fluido perfluoroquímica. O uso de partículas está a ser desenvolvido para ajudar os bebês tratar com pulmões danificados.
Outras aplicações postuladas incluem mergulho em alto mar e viagens espaciais, os aplicativos que tanto necessitam de ventilação líquida total, e não de ventilação parcial. O filme de 1989 The Abyss mostrou uma utilização fictícia de perfluorocarbono para o mergulho humano, mas também filmou um rato verdadeiro sobreviver enquanto arrefecida e imerso em perfluorocarbono. (Veja também lista de tratamentos fictícios de respiração perfluorocarbono.)
Perigos
Flúor gasoso e iões de fluoreto

Flúor elementar é altamente tóxico. Acima de uma concentração de 25 ppm, flúor provoca irritação significativa enquanto ataca os olhos, vias respiratórias, pulmões, fígado e rins. A uma concentração de 100 ppm, olhos e narizes humanos estão seriamente danificados.
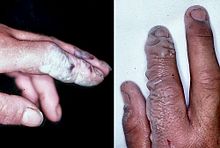
Fluoretos solúveis são moderadamente tóxico. Para o fluoreto de sódio, a dose letal para adultos é de 5-10 g, o qual é equivalente a 32-64 mg de fluoreto elementar por quilograma de peso corporal. A dose que pode levar a efeitos adversos para a saúde é de cerca de um quinto da dose letal. Crônica consumo excessivo de flúor pode levar a fluorose óssea, uma doença dos ossos que afeta milhões na Ásia e África.
O ião fluoreto é prontamente absorvido pelo estômago e intestinos. Ingerido formas de fluoreto de ácido fluorídrico no estômago. Nesta forma, fluoreto atravessa as membranas celulares e liga-se então com cálcio e interferir com várias enzimas. O flúor é excretado através da urina. Limites de exposição ao flúor são baseados em testes de urina, que determinou a capacidade do corpo humano para libertar-se do flúor.
Historicamente, a maioria dos casos de intoxicação por flúor ter sido causado por ingestão acidental de inseticidas que contêm flúor inorgânico, atualmente, a maioria das chamadas para centros de controle de veneno para uma possível intoxicação por flúor vêm da ingestão de flúor contendo creme dental. Mau funcionamento de equipamentos de fluoretação da água ocorreu várias vezes, incluindo um incidente do Alasca, o que afetou cerca de 300 pessoas e matou um.
Acido hidrosulfurico
O ácido fluorídrico é um veneno de contacto e devem ser manuseados com extremo cuidado, muito além do que o concedido a outros ácidos minerais. Devido à sua menor dissociação química em água (remanescente de uma molécula neutra), fluoreto de hidrogénio penetra o tecido mais rapidamente do que os ácidos típicos. A intoxicação pode ocorrer facilmente através da exposição da pele ou olhos, ou quando inalado ou ingerido. Os sintomas da exposição ao ácido fluorídrico pode não ser imediatamente evidente, com um atraso de 8 horas para 50% de HF e até 24 horas, se a concentração é menor. Fluoreto de hidrogênio interfere com a função do nervo, o que significa que as queimaduras não pode inicialmente ser doloroso. Exposições acidentais podem passar despercebidos, atrasando o tratamento e aumentando a extensão ea gravidade da lesão. Se a queimadura foi notado inicialmente, seguida de HF deve ser lavado com um fluxo vigoroso de água durante dez a quinze minutos, para evitar a sua penetração no corpo. Roupa usada pela pessoa que sofreu queimaduras também podem apresentar perigo.
Uma vez no sangue, fluoreto de hidrogénio reage com o cálcio e de magnésio, resultando em desequilíbrio electrólito, arritmia cardíaca, e, potencialmente, a morte. Formação de insolúvel fluoreto de cálcio possivelmente provoca tanto uma queda no cálcio no soro e a forte dor associada com a toxicidade dos tecidos. Em alguns casos, a exposição pode levar a hipocalcemia. Queimaduras com áreas maiores do que 160 centímetros 2 (25 em 2 ) pode causar toxicidade sistêmica grave de interferências com os níveis sanguíneos de cálcio e tecido.
A exposição do ácido fluorídrico é muitas vezes tratada com gluconato de cálcio, uma fonte de Ca 2+ que se liga com os iões de fluoreto. Queimaduras na pele pode ser tratada com uma lavagem com água e 2,5% de gel de gluconato de cálcio ou de soluções especiais de lavagem. No entanto, por causa do HF é absorvido, o tratamento médico é necessário; por vezes, amputação pode ser necessária.
As preocupações ambientais
Atmosfera
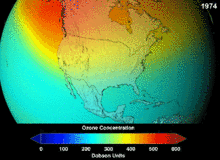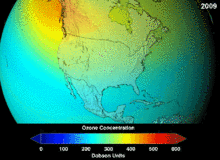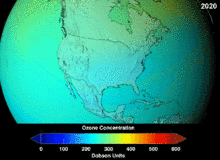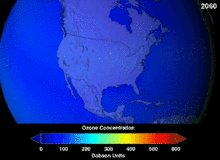
Clorofluorcarbonos (CFCs) e bromofluorocarbonos (BFCS) foram estritamente regulado através de uma série de acordos internacionais, o Protocolo de Montreal, porque eles destroem a camada de ozônio. É o cloro e o bromo a partir destas moléculas que causam danos, não flúor. Devido à estabilidade inerente destas moléculas totalmente halogenados (que os torna tão inflamável e útil), eles são capazes de atingir os alcances superiores da atmosfera, antes de se decompor, e então solte cloro e bromo para atacar o ozônio nessas altitudes. As previsões são de que as gerações serão obrigados, mesmo após a proibição do CFC, por estas moléculas para deixar a atmosfera e para a camada de ozono para se recuperar. As primeiras indicações são de que a depleção da proibição CFC está trabalhando em ozono parou e recuperação está em andamento.
Hidroclorofluorcarbonos (HCFCs) são substituições atuais para CFCs; HCFCs têm cerca de um décimo do ozônio prejudicando potencial (ODP) de CFCs. Eles foram originalmente programado para a eliminação até 2030 nos países desenvolvidos (2.040 no subdesenvolvido). Em 2007, um novo tratado foi assinado por quase todas as nações para mover a eliminação por 10 anos porque HFCs, que não têm cloro e, portanto, de zero ODP, estão disponíveis. Enquanto isso, os HCFC individuais com o maior potencial de empobrecimento do anti-ozônio estão sendo eliminados em primeiro lugar. Por exemplo, em 2003, HCFC-141b foi extinto em os EUA pela regulamentação Agência de Proteção Ambiental. Muitos dos outros HCFCs estão agora a ser produzido numa fracção dos seus níveis de produção anteriores.
Fluorcarboneto gases de todos os tipos (CFCs, HFCs, etc.) são gases de efeito estufa cerca de 4.000 a 10.000 vezes mais potente que o dióxido de carbono. Hexafluoreto de enxofre exibe um efeito ainda mais forte, cerca de 20.000 vezes o potencial de aquecimento global do dióxido de carbono.
Biopersistance

Devido à resistência da ligação de carbono-flúor, organofluorines suportar no ambiente. O ácido perfluorooctanóico (PFOA) e ácido perfluorooctano (PFOS), utilizado em sprays de impermeabilização, são contaminantes globais persistentes. Quantidades vestigiais de essas substâncias têm sido detectados em todo o mundo, a partir de ursos polares no Ártico para a população humana global. Um estudo indica que os níveis de PFOS em vida selvagem estão começando a ir para baixo por causa da recente produção reduzida desse produto químico.
Distribuição nos tecidos de PFOA em seres humanos é desconhecida, mas os estudos em ratos sugerem que é provável que esteja presente principalmente no fígado, rim, e sangue. No corpo, o PFOA se liga a uma proteína, albumina de soro; foi detectada no leite materno e no sangue de recém-nascidos. PFOA não é metabolizado pelo organismo, mas é excretada pelos rins.
Os potenciais efeitos na saúde de PFOA não são claras. Ao contrário de hidrocarbonetos clorados, PFOA não é lipofílica (armazenado em gordura), nem é genotóxicos (genes prejudiciais). Embora ambos PFOA e PFOS causa câncer em quantidades elevadas em animais, estudos em seres humanos expostas não foram capazes de provar ter um impacto em exposições atuais. Roazes têm algumas das maiores concentrações de PFOS de todos os animais selvagens estudadas; um estudo sugere um impacto sobre os seus sistemas imunitários.
Como os sistemas biológicos não metabolizar moléculas fluorados facilmente, produtos farmacêuticos fluorados (muitas vezes antibióticos e antidepressivos) estão entre os principais produtos orgânicos fluorados presentes no esgoto da cidade tratado e de águas residuais. Agroquímicos contendo flúor são mensuráveis em terras agrícolas enxurrada e rios próximos.
Compostos

Só comuns de flúor estado de oxidação é -1. Com outros átomos de flúor, formas, quer ligações covalentes polares ou ligações iônicas. Mais frequentemente, ligações covalentes envolvendo átomos de flúor são ligações simples, embora existam, pelo menos, dois exemplos de uma ligação de ordem superior. O flúor pode actuar como um ligando em ponte entre os dois metais em algumas moléculas complexas. Moléculas contendo flúor também podem apresentar ligação de hidrogénio. Flúor tem uma química rica incluindo compostos inorgânicos formados com hidrogênio, metais, não-metais e gases nobres mesmo; bem como um conjunto diverso de compostos orgânicos.
Inorgânico
Fluoreto de hidrogênio
| HF e H2semelhanças S | |
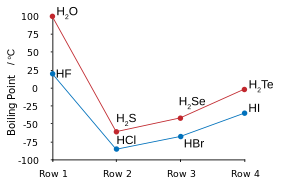 |  |
| Pontos de ebulição dos halogenetos de hidrogênio (azul) e calcogenetos de hidrogênio (vermelho): HF e H2S tendências pausa. | Ponto de HF / h congelamento2misturas S: setas indicam compostos no estado sólido. |
Flúor combina com hidrogénio para produzir um composto (IC) chamado fluoreto de hidrogénio ou, em especial no contexto das soluções de água, de ácido fluorídrico. O tipo de ligação HF é um dos poucos capazes de ligação de hidrogénio (criação de associações de agrupamento extras com moléculas semelhantes). Isso influencia vários aspectos peculiares de propriedades de fluoreto de hidrogênio. Em alguns aspectos, a substância comporta-se mais como a água, também muito propenso a ligação de hidrogénio, de um dos outros haletos de hidrogénio, tal como HCl.
Ligação de hidrogénio entre as moléculas de HF dá origem a alta viscosidade da fase líquida e a pressão mais baixa do que o esperado na fase gasosa. O fluoreto de hidrogénio não ferve até 20 ° C, em contraste com os halogenetos de hidrogénio mais pesados que destilam entre -85 ° C e -35 ° C (° F -120-30). HF é completamente miscível com a água (se dissolver em qualquer proporção), enquanto os outros halogenetos de hidrogénio têm grandes lacunas de solubilidade com a água. O fluoreto de hidrogénio e água também formar vários compostos no seu estado sólido, especialmente de 1: 1 de composto que não funde até -40 ° C (-40 ° F), que é de 44 graus Celsius (79 graus Fahrenheit) acima do ponto de fusão HF de puro.
Ao contrário de outros ácidos hidro-hálicos, tais como ácido clorídrico , ácido fluorídrico é de apenas um ácido fraco em solução de água, com constantes de dissociação de ácido (pKa uma ) igual a 3,19. A fraqueza de HF como um ácido aquoso é paradoxal, considerando como polar a ligação HF é, muito mais do que a ligação em HCl, HBr, ou HI. A explicação para o comportamento é complicado, tem a ver com várias tendências de formação de clusters de HF, água e iões de flúor, bem como questões termodinâmicos. Em grandes concentrações, uma propriedade chamada homoconjugation é revelado. HF começa a aceitar iões fluoreto, formando os iões poliatómicos (tais como bifluoreto, IC -
2 ) e protões, aumentando assim a acidez do composto. O ácido fluorídrico é também o mais forte dos ácidos hidro-halogenados em ácido acético e solventes semelhantes. Sua acidez potencial oculto também é revelado pelo fato de ele protona ácidos como o ácido clorídrico, sulfúrico ou nítrico. Apesar de sua fraqueza, ácido fluorídrico é muito corrosivo, mesmo atacando vidro (hidratado apenas).
Fluoreto de hidrogénio seco se dissolve fluoretos de metais de baixa valência prontamente. Vários fluoretos moleculares também dissolver na IC. Muitas proteínas e hidratos de carbono pode ser dissolvido em HF seco e pode ser recuperada a partir dele. A maioria dos produtos químicos inorgânicos não flúor reagem com HF, em vez de se dissolvendo.
Fluoretos de metais
Fluoretos de metal têm semelhanças com outros halogenetos de metal, mas são mais iônica. Em muitos aspectos, fluoretos de metais diferem de outros haletos de metal (cloretos, brometos, iodetos), são muito semelhantes um ao outro. Em vez disso, os fluoretos são mais semelhantes aos óxidos, tendo muitas vezes de ligação e de cristal estruturas semelhantes.
Os fluoretos de metal mostram tendências gerais com base no custo do metal. Metais em um estado de oxidação de +3 ou inferior, tendem a formar fluoretos iónicos, refractários. Metais cobrado 5 ou superior tendem a formar fluoretos ligados covalentemente, polímeros ou moléculas discretas, e são mais voláteis. (Os tetrafluorides são uma zona de transição.) As variações de ligação significa que fluoretos metálicos podem ser sólidos, líquidos ou gases à temperatura ambiente.
A solubilidade de fluoretos varia muito, mas tende a diminuir à medida que a carga sobre os aumentos de iões metálicos. Fluoretos dissolvidos produzir soluções básicas. (F - é uma base fraca, porque HF é um ácido fraco.) como hidróxidos, fluoretos podem ser vistos como base, anfotérico, e ácida, com a propriedade de acidez geralmente aumentando com o estado de oxidação do metal; um fluoreto é uma base muito mais fraco do que um hidróxido, no entanto.
Estados de oxidação baixos
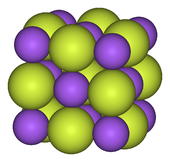
Os metais alcalinos formar monofluorides. Todos são solúveis e têm a estrutura de cloreto de sódio (sal de rocha), que também é adoptado por alguns óxidos alcalino-terrosos tais como CaO. Uma vez que o anião fluoreto é altamente básico, muitas fluoretos de metais alcalinos formam bifluoretos com a fórmula MHF 2 . Eles também libertam o fluoreto facilmente quando se faz reagir com um ácido. Entre outros monofluorides, única de prata (I) e de tálio (I) fluoretos são bem caracterizado. Ambos são muito solúvel, ao contrário dos outros halogenetos desses metais. Outra fluoreto de prata é a partir deste ponto uma "meia-flúor" (a subfluoride, composto que contém menos de saturação normal com flúor), formulado como Ag 2 F . Este composto foi descrito como tendo F - e incomuns "Ag ½ + "centros.
Ao contrário dos monofluorides, os difluorides pode ser solúvel ou insolúvel. Vários difluorides de metais de transição, tais como os de cobre (II) e níquel (II), são solúveis. Os metais alcalino-terrosos formam difluorides que são insolúveis. Em contraste, os cloretos de terras alcalinas são facilmente solúveis. A insolubilidade de fluoretos terrosos vem da energia de rede negativo alta do comum na estrutura química de fluorita (adotado por vários dióxidos de metal, tais como CeO 2 , UO 2 , ThO 2 , etc.), de modo que é mais favorável para o sólido para ficar sólida em vez de dissolver, por isso eles são insolúveis (ver a tabela, observe os sinais de menos omitidos). No entanto, o fluoreto de berílio mostra diferenças marcantes de outros fluoretos alcalino-terrosos, apenas é berílio diferente de outros metais alcalino-terrosos (tendendo a se relacionar de forma covalente, de modo BeF 2 mostra um caráter significativo covalente). Os compostos tem muitas semelhanças com SiO 2 (quartzo): a maior parte ligada por covalência de rede contínua, a formação de vidros (são difíceis de cristalizar), a mesma estrutura cristalina temperatura ambiente quando cristalina, etc É muito solúvel em água, ao contrário dos outros terrosos .
Forma Muitos metais trifluorides, tais como o ferro, o bismuto, os elementos de terras raras, e os metais de alumínio na coluna da tabela periódica. Neste ponto, a ionicidade dos fluoretos começa a diminuir, e a acidez começa a crescer, apesar de os compostos ainda são sólidos, principalmente iónicos fracamente básicos. Em muitos casos, enquanto as trifluorides ainda são iónico, tri-halogenetos de outros podem ser voláteis (por exemplo, alumínio ou ouro). Nenhuma trifluoreto é solúvel em água, mas são solúveis em muitos outros solventes.
O tetrafluorides mostram uma mistura de ligação iónica e covalente: zircónio, háfnio, além de muitos dos actinídeos formar tetrafluorides iónico, de alto ponto de fusão-antiprismatic quadrados. Titânio, nióbio, vanádio e tetrafluorides são poliméricos, com o ponto de fusão ou de decomposição pontos abaixo de 400 ° C (de vanádio pode também desproporcionada a 100-120 ° C até o trifluoreto e o pentafluoreto). Muitos tetrafluorides metais de transição mostram estruturas incomuns intermediários entre covalente iônica e monomérico (tetrafluoride nomeadamente irídio com ambos os átomos de flúor compartilhados e não compartilhados). Eles têm tipicamente pontos de baixo ponto de fusão (tetrafluoreto de ósmio é, por exemplo, 230 ° C) ou são de baixa estabilidade (tetrafluoreto de manganês decompõe mesmo à temperatura ambiente). germânio formas de tetrafluoreto de moléculas tetraédricas e é um gás à temperatura ambiente.
Estados de oxidação alta
Penta de metal e fluoretos mais elevados são todos ligados covalentemente e volátil. Este comportamento contrasta com os óxidos correspondentes. O oxigénio é um oxidante mais forte e inerentemente mais propensos a formar ligações covalentes, mas apenas faz com cinco moléculas de metais ( heptoxide manganês, tecnécio heptoxide, tetróxido de ruténio, tetróxido de ósmio, e irídio) tetróxido. Formas de flúor moléculas com quinze metais por causa de seu pequeno tamanho e taxa única como um íon permite circundante átomos de metal com mais átomos de flúor do que o oxigênio pode.
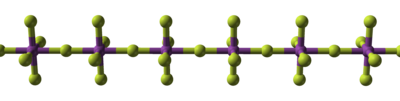

Mais alto de fluoreto de bismuto é um pentafluoreto volátil que é um poderoso agente de fluoração. No estado sólido, é polimérico, que consiste em cadeias lineares de octaedro, que partilham fluoretos axiais. Bismuto pentavalentes comporta-se como um ácido e formas hexafluorobismuthate, [bif 6 ] - , por reacção com um dador de flúor, ou forte (tal como NaF) ou não (tais como Xef 4 ), sendo, portanto, um ácido. Nióbio e tântalo pentafluorides, enquanto termicamente estável, são também ácidos fortes e, assim, hidrolisar facilmente. Eles são verdadeiramente molecular, formando moléculas tetraméricas. Muitos metais que formam fluoretos mais elevadas podem também formar pentafluorides, mas eles podem ser instáveis. Por exemplo, ósmio e ruténio pentafluorides, enquanto também polimérico, tem uma estrutura diferente, e são de baixa estabilidade (hidrolisam facilmente, não são do estado de oxidação mais alto, nem um um estável).
Os metais que tornam bem caracterizados incluem hexafluorides nove metais no centro da tabela periódica e três actinídeos . À temperatura ambiente, o hexafluoreto de tungstênio é um gás, hexafluoreto de molibdênio e rênio hexafluoreto são líquidos, e os restantes são sólidos voláteis. Metal hexafluorides são oxidantes por causa de sua tendência a ficar reduzida: por exemplo, o hexafluoreto de platina foi o primeiro composto para oxidar o oxigênio molecular e xenon. O hexafluoreto menos instável que é de ósmio. polónio também forma um hexafluoreto, mas é pouco estudada.
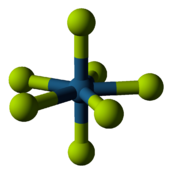
Rênio é o único metal conhecido por se relacionar com sete fluoretos em composto de metal de carga neutra, que é o cobrado-ligantes registro número. Rhenium heptafluoride podem ser sintetizados a partir dos elementos, e é relativamente estável contra o calor. Quimicamente, pode servir como um ácido não-oxidante de modo a formar o anião correspondente, ReF -
8 , ou com ácidos mais fortes como uma base para formar um catião, ReF +
6 . A molécula adopta uma geometria molecular bipirâmide pentagonal (prevista para ser compartilhado com o atualmente desconhecida, mas talvez possível heptafluoride irídio (relatório de síntese está sendo preparado), tecnécio heptafluoride, e ósmio heptafluoride).
Fluoretos metalóide
O fluoretos binários metalóide são compostos voláteis. Eles mostram uma grande diferença entre o período de 2 e outros fluoretos. Por exemplo, elementos de época dois elementos fluoretos nunca exceda o octeto de seus átomos. ( Boron é uma exceção devido à sua posição específica na tabela periódica.) Lower elementos do período, no entanto, podem formar moléculas hipervalentes, como pentafluoride de fósforo ou hexafluoreto de enxofre. A reactividade de tais espécies varia muito, hexafluoreto de enxofre é inerte, enquanto trifluoreto de cloro é extremamente reactivo, mas existem algumas tendências baseadas em locais de tabela periódica.
Trifluoreto de boro é uma molécula plana. Ele tem apenas seis elétrons em torno do átomo de boro centrais (e, portanto, um octeto incompleto), mas prontamente aceita uma base de Lewis, formando adutos com moléculas ou íons como solitário contendo-par amônia ou outro íon flúor, que pode doar mais dois elétrons para completar o octeto. Boron monofluoretado é uma molécula instável com uma (superior a única) uma ligação incomum para flúor. A ordem de ligação tem sido descrito como 1,4 (intermediário entre uma ligação simples e dupla). É isoeletrônica com N 2 .
Tetrafluoreto de silício, semelhante ao tetrafluoreto de carbono e germânio tetrafluoride, adota uma molecular tetrahedral estrutura. SiF 4 é estável contra o aquecimento ou faísca elétrica, mas reage com a água (mesmo ar úmido), metais e álcalis, demonstrando, assim, caráter ácido fraco. As reacções com compostos de organomagnésio, álcoois, aminas e compostos de adução de rendimento de amoníaco. ácido fluorossilícico, de um derivado SiF 4 , é um ácido forte em solução aquosa (a forma anidra não existe).
Pnictogens (coluna da tabela periódica de azoto) mostram tendências muito semelhantes em reactividade e a acidez das maiores fluoretos (pentafluorides) e as mais comuns (trifluorides), com a referida propriedade aumentando para baixo o grupo: NF 3 é estável contra a hidrólise, PF 3 hidrolisa muito lentamente em ar úmido, enquanto AsF 3 hidrolisa completamente. SbF 3 hidrolisa apenas parcialmente por causa da crescente carácter iónico da ligação ao flúor. Os compostos são fracas bases de Lewis, com NF 3 novamente ser uma exceção. Os pentafluorides de fósforo e arsênico são muito mais reativo do que os seus trifluorides; pentafluoreto de antimónio é um ácido forte tal que ele detém o título de o ácido de Lewis mais forte. Azoto não é conhecida para formar um pentafluoreto, embora o catião tetrafluoroammonium ( NF +
4 ) apresenta azoto no estado de oxidação formal de 5. monofluoretado azoto é um grupo espécie metastável que tem sido observada em estudos de laser. É isoeletrônica com O 2 e como BF, raramente, tem uma ordem de ligação maior do que um único ligado flúor.
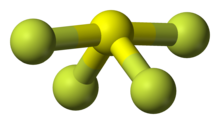
O Calcogênios (coluna tabela periódica de oxigênio) são um pouco semelhantes: Os tetafluorides são termicamente instável e hidrolisar, e também está pronto para usar seu par solitário para formar adutos a outros (ácidos) fluoretos. Enxofre e selênio são tetrafluorides molecular enquanto TEF 4 é um polímero. Os hexafluorides são o resultado de fluoração direta dos elementos (compare: outros hexahalides dos elementos sequer não existe). Eles aumentam a reactividade com número atómico: SF 6 é extremamente inerte, Sef 6 é menos nobre (por exemplo, reage com amoníaco a 200 ° C (400 ° F)), e Tef 6 facilmente hidrolisa para dar um oxoácido. Maior fluoreto de oxigênio é difluoride oxigênio, mas o flúor pode, teoricamente (a partir de 2012) oxidar-lo a um estado excepcionalmente alta oxidação de +4 na fluorocation: DE +
3 .
Os halogéneos bem caracterizados mais pesados (cloro, bromo, e iodo) todas as formas mono-, tri-, e pentafluorides: XF, XF 3 , e XF 5 . Das sete espécies neutras, única heptafluoreto de iodo é conhecida. Enquanto cloro e bromo heptafluorides não são conhecidos, os cátions correspondentes CLF +
6 e BRF +
6 , oxidantes extremamente forte, são. Astatine não é bem estudado, e, embora não é um relatório de um monofluoretado astatine não volátil, a sua existência é debatido. Muitos dos fluoretos de halogénio são fluorinators poderosos. O cloro trifluoreto é particularmente notável-prontamente fluoração de amianto e óxidos refratários e pode ser ainda mais reativo do que pentafluoride cloro. Usado industrialmente, ClF 3 requer precauções especiais semelhantes àquelas para o flúor gasoso devido à sua corrosividade e riscos para seres humanos.
Superácidos
Vários ácidos inorgânicos importantes contêm flúor. Eles são geralmente muito forte devido à elevada electronegatividade do flúor. Um tal ácido, ácido fluorantimônico (HSbF 6 ), é o ácido mais forte carga neutra conhecido. A dispersão da carga no anião afecta a acidez do protão solvatado (em forma de H 2 F + ): O composto tem um extremamente baixo pK uma de -28 e 10 é quatrilhão (10 16 ) vezes mais forte do que o ácido sulfúrico puro. Ácido fluorantimônico é tão forte que protona compostos então inertes como os hidrocarbonetos. Químico húngaro-americano George Olah recebeu o Prêmio Nobel 1994 em química para investigar tais reações.
Compostos de gases nobres
Os gases nobres são em geral não-reactivo, porque eles têm totalmente preenchido conchas electrónicos, que são extremamente estáveis. Até a década de 1960, nenhuma ligação química com um gás nobre era conhecida. Em 1962, Neil Bartlett usadas contendo flúor hexafluoreto de platina para reagir com xenon. Ele chamou o composto preparou hexafluoroplatinato xenon, mas desde então o produto foi revelado para ser mistura de diferentes produtos químicos. Bartlett provavelmente sintetizada uma mistura de monofluoroxenyl (II) pentafluoroplatinate, [XEF] + [PTF 5 ] - , monofluoroxenyl (II) undecafluorodiplatinate, [XEF] + [Pt 2 F 11 ] - , e trifluorodixenyl (II) hexafluoroplatinato, [Xe 2 F 3 ] + [PTF 6 ] - . Fluoração de xenon de Bartlett tem sido chamado um dos dez mais belas experiências da história da química. Mais tarde, em 1962, xenon foi relatado para reagir diretamente com flúor para formar o di- e tetrafluorides. Desde então, os químicos têm feito grandes esforços para formar outros fluoretos de gases nobres.
Tendo começado a nobre classe compostos gases-de flúor, xenon é também o gás nobre para ter as mais conhecidas desses compostos. Seus compostos incluem binários de difluoreto de xénon, tetrafluoreto de xénon, e hexafluoreto de xénon, bem como os seus derivados. Xenon forma vários oxifluoretos, tais como xénon oxydifluoride, XeOF 2 , por reacção de tetraf luoreto de xénon com água. O seu vizinho superior, crípton, é o único outro para formar um composto bem estabelecida: difluoreto de crípton. Krypton tetrafluoreto foi relatado em 1963, mas foi subsequentemente demonstrado ser uma identificação errada; o composto parece ser muito difícil de sintetizar agora (embora até mesmo o hexafluoreto podem existir).
Em forte acordo com as tendências periódicas, radônio é notavelmente mais reativa a oxidantes, incluindo flúor. Tem sido demonstrado que reagem facilmente com flúor, para formar um composto sólido, que é geralmente considerado para ser difluoreto de radão. A composição exacta é incerta, como o composto é sujeito a decomposição. Os cálculos indicam que o radão difluoride podem ser iónicos, ao contrário de todos os outros fluoretos de gases nobres binários.
Os gases nobres mais leves (de hélio através de argônio) não formam fluoretos binários estáveis. Formas de fluoreto de argônio não binário, mas reage em condições extremas com fluoreto de hidrogênio para formar argônio fluorohydride; é o único "estável" composto de árgon. Hélio e néon não formam quaisquer compostos químicos estáveis em tudo. Hélio forma hélio fluorohydride; tem sido mostrado a ser instável em fase gasosa, mas existem condições específicas para as quais podem ser estáveis. Néon, o elemento menos reactivo, não se espera agora para formar um composto estável, capaz de síntese.
Ununoctium , o último atualmente conhecido grupo de 18 elementos , está previsto para formar difluoride ununoctium, UuoF 2 , e tetrafluoreto ununoctium, UuoF 4 , o que é susceptível de ter a geometria molecular tetraédrica. No entanto, apenas alguns átomos de ununoctium têm sido sintetizados e as suas propriedades químicas não foram examinados.
Mais elevados estados de oxidação: flúor contra oxigênio
Alcanos parcialmente fluorados são os hidrofluorocarbonetos (HFC). Substituindo outros halogéneos, em combinação com flúor dá origem a clorofluorocarbonetos (CFCs) ou bromofluorocarbonos (BFCS) e semelhantes (se algum hidrogénio é retida, HCFC e outros semelhantes). Propriedades depender do número e identidade dos átomos de halogéneo. Em geral, os pontos de ebulição são ainda mais elevada pela combinação de átomos de halogénio, porque o tamanho variável e carga de diferentes halogéneos permite atracções intermoleculares mais. Tal como acontece com fluorocarbonetos, clorofluorocarbonos e bromofluorocarbonos não são inflamáveis: eles não têm ligações carbono-hidrogênio para reagir e halogenetos liberados extinguir as chamas. 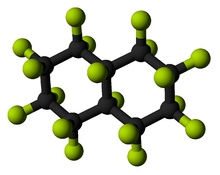 Quando todos os hidrogénios são substituídos por flúor para atingir perfluoroalcanos, uma grande diferença é revelada. Tais compostos são extremamente estáveis, e apenas de sódio em amoníaco líquido ataca em condições normalizadas. Eles também são muito insolúveis, com alguns solventes orgânicos capazes de dissolvê-los. No entanto, se um perfluorocarbono contém ligações duplas ou triplas (perfluorados alcenos ou - alcinos)., um muito reativo em direção ligando resultado aceitar, até mesmo menos estável do que os hidrocarbonetos correspondente Difluoroacetylene, que se decompõe, mesmo sob temperaturas de nitrogênio líquido, é um exemplo notável. Se uma tal molécula é assimétrico, então o carbono mais fluorado é atacada, visto que tem carga positiva causado pelas ligações C-F e é fracamente blindado (de forma semelhante à que como hidrocarbonetos insaturados atacadas por HF adicionar hidrogénio ao átomo mais rico em hidrogénio por Regra de markovnikov). Os compostos perfluorados, em oposição a perfluorocarbonetos, é o termo usado para moléculas que seriam-perfluorocarbonetos apenas de carbono e átomos de flúor, exceto para ter um grupo funcional adicional (mesmo que existe uma outra definição). Eles partilham a maior parte das propriedades de hidrocarbonetos perfluorados (inércia, estabilidade, não-wettingness e insolubilidade em água e óleos, deslizamento, etc), mas podem ser diferentes por causa das propriedades de grupos funcionais, embora a cauda perfluorocarbono diferem das propriedades específicas de grupo, em comparação com aqueles compostos de rabo-de-hidrocarbonetos. Perfluoroalkanic ácidos de ácidos orgânicos também podem ser vistas como compostos perfluorados, com perfluoroalquilo ligado a um grupo carboxilo. À medida que os átomos de flúor são adicionados ao ácido, aumenta a sua resistência: Considere ácido acético e os seus mono-, di-, e derivados trifluoroacético e as suas pK uma valores (4,74, 2,66, 1,24, e 0,23). Isso acontece porque, com átomos de flúor, o ânion formado após dar o próton fora se torna estável, um efeito causado pela grande de flúor efeito indutivo. Devido a isso, o derative trifluoro é 33.800 vezes mais forte do que um ácido acético. Da mesma forma, a acidez é muito maior para outros ácidos perfluorocarboxyl, bem como as aminas (aqui, faz mais sentido falar sobre eliminação de basicidade, embora). Os ácidos perfluoroalcanosulfónico também são muito notáveis por sua acidez. O derivado de ácido sulfónico, ácido trifluorometanossulfónico, é comparável em força para ácido perclórico. Estes compostos inferior da energia superficial; Por esta razão, eles, especialmente ácido perfluorooctano (PFOS, anteriormente o componente activo em marca "Scotchgard") têm encontrado uso industrial como surfactantes (ver acima). Se um composto perfluorado tem uma cauda fluorado, mas também alguns átomos de carbono não fluorados (normalmente duas) perto do grupo funcional, que é chamado um fluorotelomer (tais moléculas são comercialmente tratado como perfluorado), mas tais moléculas são mais do que de valor industrial química. A extremidade da cadeia podem ser similarmente ligado a diferentes grupos functiuonal (através do carbono terminal hidrogenado), tal como hidroxilo resultando em álcoois fluorotelomer, sulfonato resultante em sulfonatos fluorotelomer, etc. PolímerosFluoropolymers são semelhantes em muitos aspectos com moléculas menores; adição de um polímero de flúor afecta as propriedades da mesma maneira que no moléculas pequenas (aumento da estabilidade química, ponto de fusão, reduzindo a inflamabilidade, a solubilidade, etc). Cada fluoropolímero tem propriedades características possui, no entanto. O mais simples fluoroplástico é politetrafluoroetileno (PTFE, DuPont marca de Teflon), que é um polímero de cadeia simples linear, com a repetição da unidade estrutural: -CF 2 -. PTFE tem uma espinha dorsal de átomos de carbono ligado por ligação simples em uma cadeia longa, com todas as ligações laterais para flúores. Ele não contém átomos de hidrogénio e pode ser pensado como o análogo de perfluoro de polietileno (unidade estrutural: -CH 2 -). PTFE tem alta estabilidade química e térmica, como seria de esperar para um perfluorocarbono, muito mais forte do que o polietileno. Sua resistência a forças de van der Waals faz PTFE a superfície conhecida apenas para que uma lagartixa não pode furar. O composto, no entanto, carece de uma capacidade de transformar em cima de fusão, que não é um problema por várias deratives PTFE, ou seja, FEP ( propeno eteno fluorado, com alguns átomos de flúor substituídos com o -CF 3 grupo) ou PFA ( perfluoroalcoxi, alguns substituídos com átomos de flúor - OCF 3 ). Eles compartilham a maioria das propriedades com PTFE, mas ainda há diferenças de temperatura de uso, ou seja, máximo (mais alto para o PTFE não flexível). Há outras que não sejam perfluorado fluoroplásticos. fluoreto de polivinilideno (PVDF, unidade estrutural: -CF 2 CH 2 -), é um análogo de PTFE com metade dos átomos de flúor. PVF ( fluoreto de polivinila, unidade estrutural: CH 2 ICC-) contém uma um quarto do flúores de PTFE. Apesar disso, ele ainda tem muitas propriedades de compostos mais fluorados. PCTFE ( policlorotrifluoroetileno, unidade estrutural: CF 2 CFCl-) é outro importante composto. Ela difere de PTFE por ter um trimestre de flúor substituído com cloros, mas esta diferença traz ainda maior dureza, resistência à fluência, e umidade persistência. Fluoração moderada do polietileno dá não faz todo o plástico perder seus hidrogênios para flúor; apenas uma camada fina (0,01 mm a máxima) é então afectada. Isso é um tanto semelhante à passivação do metal: as propriedades de volume não são afectados, mas as propriedades de superfície são, sobretudo, uma maior barreira de vapor. Por conseguinte, eles são uma alternativa mais barata à plásticos perfluorados se apenas a superfície é importante. 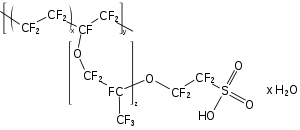 Nafion é um polímero estruturalmente complicado. Ele tem uma espinha dorsal de PTFE-like, mas também contém cadeias laterais de éter de perf luoroalquilo que terminam em ácido sulfónico (-SO 2 OH) groups. Ele também possui grande estabilidade química, enquanto as propriedades exatas variam de acordo com a morfologia. No entanto, devido à estrutura química difícil, é também relativamente facilmente convertido para um ionómero (mostra condutividade) por adição de catiões tais como Na + ou através da conversão em ácido sulfónico, em vez do que a dada fluoreto de sulfonilo. A condutividade é devido a que a cadeia principal de carbono separa-se as cadeias laterais, formando assim as regiões polares e não-polares. Esta forma também é muito higroscópico. Os fluoroelastómeros, assim como outros elastómeros (borrachas artificiais), consistem de cadeias de polímeros ligadas desordenados em três dimensões. Os principais desafios para tornar fluorelastomers são cross-linking (reacção dos polímeros não reactivos), bem como a remoção do HF formado durante a cura. Existem três famílias principais de fluoroelasters. VDF / HFP é um sistema de copolímero de fluoreto de vinilideno e (pelo menos 20%) hexafluoropropileno. TFE / propileno é um outro sistema copylymer com melhor resistência química a alguns solventes. TFE / PMVE (éter perfluoromethylvinyl) é um sistema de copolímero que cria um elastómero fluorado perfluorado. |
|---|
