
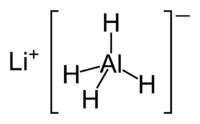
Hidreto de alumínio e lítio
Fundo para as escolas Wikipédia
SOS acredita que a educação dá uma chance melhor na vida de crianças no mundo em desenvolvimento também. Um link rápido para o patrocínio criança é http://www.sponsor-a-child.org.uk/
| Hidreto de alumínio e lítio | |
|---|---|
 | |
 | |
 | |
Hidreto de alumínio e lítio | |
Outros nomes LAH, alanato de lítio, | |
| Identificadores | |
| Número CAS | 16853-85-3 |
| Número RTECS | BD0100000 |
| Propriedades | |
| Fórmula molecular | LiAlH4 |
| Massa molar | 37,95 g / mol |
| Aparência | cristais brancos (amostras puras) pó cinza (material comercial) |
| Densidade | 0,917 g / cm 3, sólido |
| Ponto de fusão | 150 ° C (423 K), decomposição |
| Solubilidade em água | reativo |
| Estrutura | |
| A estrutura de cristal | monoclinic |
| Perigos | |
| R / S declaração | R: 15 S: 08/07, 24/25, 43 |
| Principal Perigos | altamente inflamável |
| NFPA 704 |  2 3
2 |
| Os compostos relacionados | |
| Relacionado hidreto | hidreto de alumínio boro-hidreto de sódio hidreto de sódio |
| Excepto quando indicado, os dados são dados para materiais no seu estado normal (a 25 ° C, 100 kPa) | |
| Referências de Infobox | |
Hidreto de alumínio e lítio ( Li Al H 4), comummente abreviado para LAH, é um agente de redução usado em síntese orgânica. É mais poderoso do que o relacionado reagente borohidreto de sódio devido à fraca ligação Al-H em comparação com a ligação BH. Ele irá converter ésteres, ácidos carboxílicos , e cetonas para os correspondentes álcoois ; e amida, nitro, nitrilo, imina, oxima, e Os compostos de azida para as aminas .
Disponibilidade e manipulação
LAH é um branco amostras sólidas mas comerciais são quase sempre cinza devido à contaminação com vestígios de alumínio metal. Este material pode ser purificado por recristalização a partir de éter dietílico. Purificações em grande escala empregar um Extractor Soxhlet. Geralmente, o material cinzento impuro é utilizado na síntese, uma vez que as impurezas são separadas inócuo e facilmente a partir dos produtos orgânicos. O material puro é pirofórico. Alguns materiais comerciais contêm óleo mineral para inibir reações com a umidade atmosférica, mas mais comumente, é embalada em sacos de plástico à prova de umidade.
LAH violentamente reage com a água , incluindo a humidade atmosférica. A reacção prossegue de acordo com a seguinte equação: idealizada
- LiAlH 4 + 4 H2O → LiOH + Al (OH) 3 + 4 H 2 ↑
Esta reacção fornece um método útil para gerar hidrogénio no laboratório. Amostras envelhecidas, exposta ao ar, muitas vezes aparecem em branco, porque eles têm absorvido umidade suficiente para gerar uma mistura dos compostos incolores e hidróxido de lítio hidróxido de alumínio.
Preparação
LAH foi preparado pela primeira vez a partir da reacção entre o hidreto de lítio (LiH) e cloreto de alumínio :
- 4 LiH + AlCl3 → LiAlH 4 + 3 LiCl
Além deste método, a síntese industrial envolve a preparação inicial de hidreto de alumínio e sódio a partir dos elementos sob alta pressão e temperatura:
- Na + Al + 2 H 2 → NaAlH 4
LAH é então preparado por reacção de metátese de acordo com:
- NaAlH 4 + LiCl → LiAlH4 + NaCl
que prossegue com um rendimento elevado de LAH. LiCl é removido por filtração a partir de uma etéreo solução de LAH, com subsequente precipitação de LAH de modo a produzir um produto contendo cerca de 1% w / w de LiCl.
Outros tetrahydridoaluminiumates
Uma variedade de sais análogos LAH são conhecidos. NaH pode ser utilizado para produzir de forma eficiente o hidreto de alumínio e sódio (NaAlH 4) pela metátese em THF:
- LiAlH4 + NaH → NaAlH 4 + LiH
Hidreto de alumínio e potássio (KAlH 4) pode ser produzido de forma semelhante em diglima como um solvente de resolução:
- LiAlH4 + KH → KAlH 4 + LiH
O inverso, ou seja, a produção de LAH de sódio ou hidreto de alumínio ou hidreto de alumínio e de potássio podem ser obtidas por reacção com LiCl em éter dietílico ou THF:
- NaAlH 4 + LiCl → LiAlH4 + NaCl
- KAlH 4 + LiCl → LiAlH4 + KCl
"Alanato de magnésio" (Mg (AlH 4) 2) surge utilizando semelhante MgBr 2:
- 2 LiAlH4 + MgBr2 → Mg (AlH 4) 2 + 2 LiBr
Utilização em química orgânica
Hidreto de alumínio e lítio é amplamente utilizado em química orgânica como uma agente redutor. Apesar de lidar com os problemas associados com a sua reactividade, que é mesmo utilizada em pequena escala industrial, embora para as reduções em larga escala o reagente relacionado de sódio bis (2-metoxietoxi) hidreto de alumínio, vulgarmente conhecido como Red-Al, é mais frequentemente usado. Para tais fins, é geralmente usado em solução em éter dietílico, e uma tratamento em meio aquoso é normalmente realizado após a redução, a fim de remover os subprodutos inorgânicos.
LAH é mais comumente utilizado para a redução de e ésteres de ácidos carboxílicos a álcoois primários; antes do advento de LiAlH4 esta foi uma conversão envolvendo difícil de sódio metálico em ebulição etanol (o Redução Bouveault-Blanc). Os aldeídos e cetonas podem também ser reduzidos para os álcoois de LAH, mas isto é normalmente feito usando reagentes mais suaves, tais como NaBH4. α, cetonas β-insaturados são reduzidas a álcoois alílicos. Quando epóxidos são reduzidos usando LAH, o reagente ataca a menos final impedido do epóxido, geralmente a produção de um álcool secundário ou terciário. Epoxycyclohexanes são reduzidos para dar os álcoois axiais preferencialmente.
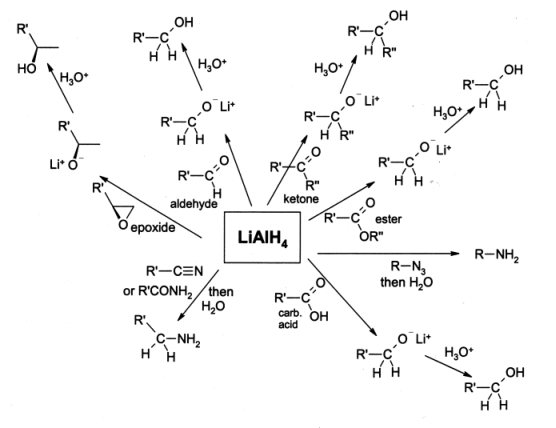
Usando LAH, aminas podem ser preparados pela redução de amidos ,, oximas, nitrilos, compostos nitro ou alquilo azidas.
Hidreto de alumínio e lítio também reduz halogenetos de alquilo de alcanos , embora esta reacção é raramente utilizados. Iodetos de alquilo reagir o mais rápido, seguido por brometos de alquilo e cloretos, em seguida, alquilo. Halogenetos primários são os mais reactivos seguido por halogenetos secundários. Halogenetos terciários reagir apenas em certos casos.
Hidreto de alumínio e lítio não reduz simples alcenos , arenes, e alquinos só são reduzidas se um álcool grupo fica nas proximidades.
Química inorgânica
LAS é amplamente utilizado para preparar principais grupos e hidretos de metais de transição a partir do metal correspondente halogenetos.
A decomposição térmica
À temperatura ambiente é LAH metastable. Durante a armazenagem prolongada que pode decompor-se lentamente com Li 3 AlH 6 e LiH. Este processo pode ser acelerado pela presença de catalíticos , por exemplo, elementos Ti , Fe , V .
Quando LAH aquecida decompõe em um de três passos Mecanismo de reacção.
- LiAlH4 → ⅓ Li 3 AlH 6 + ⅔ Al + H 2 (R1)
- ⅓ Li 3 AlH 6 → LiH + ⅓ Al + ½ H 2 (R2)
- LiH + Al LiAl → + ½ H2 (R3)
R1 é normalmente iniciado pelo fusão de LAH em torno de uma temperatura de 150-170 ° C imediatamente seguida por decomposição em sólido Li 3 AlH 6. De 200-250 o C Li 3 AlH 6 decompõem em LiH (R2) que, posteriormente, se decompõem em LiAl acima de 400 ° C (R3). R1 é eficazmente irreversível, porque LiAlH4 é metastável. A reversibilidade de R2 não tenha ainda sido estabelecido conclusivamente. R3 é reversível com uma pressão de equilíbrio de cerca de 0,25 bar a 500 ° C. R1 e R2 podem ocorrer à temperatura ambiente, com catalisadores adequados.
De acordo com as reacções R1-R3 LiAlH4 contém 10,6% em peso de hidrogénio fazendo desse modo uma potencial LAH hidrogénio meio de armazenamento para o futuro movido a célula de combustível veículos. Bicicleta única R2 armazenaria 5,6% em peso no material numa única etapa (comparável para os dois passos de NaAlH 4).
Dados de solubilidade
LAH é solúvel em muitos etéreos soluções. No entanto, pode decompor-se espontaneamente devido à presença de impurezas catalíticas, no entanto, parece ser mais estável em THF. Assim, THF é o preferido, por exemplo sobre éter dietílico, mesmo apesar da menor solubilidade.
| Temperatura (o C) | |||||
| Solvente | 0 | 25 | 50 | 75 | 100 |
| Éter dietílico | - | 5.92 | - | - | - |
| THF | - | 2.96 | - | - | - |
| Monoglima | 1.29 | 1.80 | 2.57 | 3.09 | 3.34 |
| Diglima | 0.26 | 1.29 | 1.54 | 2.06 | 2.06 |
| Triglima | 0.56 | 0.77 | 1.29 | 1.80 | 2.06 |
| Tetraglima | 0.77 | 1.54 | 2.06 | 2.06 | 1.54 |
| Dioxano | - | 0,03 | - | - | - |
| Éter dibutílico | - | 0.56 | - | - | - |
Note-se que o hidreto de alumínio e lítio não devem ser usados com água, que reage violentamente, como descrito pela seguinte equação.
- LiAlH 4 + 4 H2O → Li + + Al 3+ + 4 OH - 4 + H 2
A estrutura de cristal
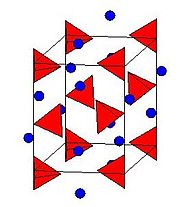
O estrutura de cristal de LAH pertence à e o sistema de cristal monoclínico grupo espacial P2 1 é c. A estrutura cristalina de LAH é ilustrado para a direita. A estrutura consiste de Li átomos rodeado por cinco AlH 4 tetraedros . Os centros de Li + são ligados a um átomo de hidrogénio a partir de átomo de cada um dos tetraedros circundante criando um arranjo bipirâmide. O célula unitária é definida como se segue: a = 4,82, b = 7,81, e N = 7,92 A, α = γ = 90 ° e β = 112 °. A pressões elevadas (> 2.2GPa) ocorre uma transição de fase para dar β-LAH.
Dados termodinâmicos
A tabela resume termodinâmicas dados para LAH e reacções envolvendo LAH, sob a forma de padrão entalpia , entropia e energia de Gibbs livre mudança, respectivamente.
| Reação | AH o (kJ / mol) | Ds O (J / (mol K)) | ΔG o (kJ / mol) | Comente |
| Li (s) + Al (s) + 2H 2 (g) → LiAlH4 (s) | -116,3 | -240,1 | -44,7 | Formação padrão dos elementos. |
| LiH (s) + Al (s) + 3/2 H 2 (g) → LiAlH4 (s) | -25,6 | -170,2 | 23,6 | Usando o AH f (LiH) = -90,5, Ds o f (LiH) = -69,9, e ΔG o f (LiH) = -68,3. |
| LiAlH4 (s) → LiAlH4 (l) | 22 | - | - | Calor de fusão. O valor é provavelmente não confiável. |
| LiAlH 4 (l) → ⅓ Li 3 AlH 6 (s) + ⅔ Al (s) + H 2 (g) | 3.46 | 104.5 | -27,68 | Ds o calculado a partir de valores reportados de AH o e ΔG o. |
