
As propriedades dos materiais de diamante
Você sabia ...
Crianças SOS tentou tornar o conteúdo mais acessível Wikipedia por esta selecção escolas. Você quer saber sobre o patrocínio? Veja www.sponsorachild.org.uk
| Diamante | |
|---|---|
 Um cristal de diamante octahedral na matriz | |
| Geral | |
| Categoria | Native Nonmetal, Mineral |
| Fórmula (Unidade de repetição) | De carbono (C) |
| Identificação | |
| Cor | Na maioria das vezes incolor a amarelo ou marrom. Raramente rosa, laranja, verde ou azul. |
| Hábito de Cristal | Octahedral, esférica ou maciço |
| Sistema cristalino | Isométrica |
| Clivagem | Octahedral; perfeita e fácil |
| Fratura | Conchoidal |
| Escala de Mohs dureza | 10 |
| Brilho | Adamantine a gorduroso |
| Risca | Nenhum |
| Diaphaneity | Limpar para não |
| Peso específico | 3,516-3,525 |
| Índice de refração | 2.417 |
| Pleochroism | Nenhum |
| Fusibilidade | Queimaduras acima de 800 ° C, o aquecimento mais de 2000 Celsius decompõe em estado sólido sem derreter. |
| Solubilidade | Resistente a ácidos, mas se dissolve irreversivelmente em aço quente |
| Principais variedades | |
| Ballas | Esférico, estrutura radial, cryptocrystalline, preto opaco |
| Bort | Mal formado, cryptocrystalline, disforme, translúcido |
| Carbonado | Maciço, microcristalina, preto opaco |
O diamante é transparente para opaco, isotrópico opticamente, 3D- cristalina de carbono . É o naturalmente mais difícil material de ocorrência conhecida devido à sua forte ligação covalente-ainda a sua tenacidade é justo bom devido a deficiências estruturais importantes. A precisão resistência à tracção de diamante é desconhecido. No entanto, força-se a 60 GPa foi observado, e a sua resistência intrínseca teórica foi calculada como sendo de entre 90 e 225 GPa, dependendo da orientação de cristal. O diamante tem um elevado índice de refração (2,417) e moderada dispersão (0,044), propriedades que são consideradas cuidadosamente durante corte de diamante e que (juntamente com a sua dureza) dar diamantes lapidados seu brilho e fogo. Os cientistas diamantes classificar em dois tipos principais e diversos subtipos, dependendo da natureza de defeitos cristalográficos presentes. Vestígios de impurezas substitucionalmente substituindo átomos de carbono em um diamante de rede cristalina, e, em alguns casos defeitos estruturais, são responsáveis por uma vasta gama de cores observadas em diamante. A maioria dos diamantes são elétricos isoladores, mas extremamente eficiente condutores térmicos. O gravidade específica de diamante de cristal único (3,52) é relativamente constante. Ao contrário do que um equívoco comum, diamante não é a forma mais estável de carbono sólido; grafite tem essa distinção.
Dureza e estrutura de cristal

Conhecido pelos antigos gregos como adamas ("tame'sles" ou "bridleless") e, por vezes chamado inflexível, o diamante é o material mais duro conhecido que ocorre naturalmente, marcando 10 no velho Escala de Mohs . O material nitreto de boro, quando em uma forma estruturalmente idêntica à do diamante, é quase tão duro quanto o diamante; um material atualmente hipotético, nitreto de carbono beta, também pode ser tão difícil ou mais difícil de uma forma. Além disso, tem sido mostrado 1 2 que ultrahard fullerite (C 60) (para não ser confundido com o P-SWNT fullerite) ao testar a dureza de diamante com um força microscópio de varredura pode arranhar diamante. Por sua vez, utilizando medições mais precisas, estes valores são agora conhecidos quanto à dureza do diamante. Um diamante Tipo IIa (111) tem um valor de dureza de 167 GPa (± 6) quando riscado com uma ultrahard ponta fullerite, enquanto uma amostra fullerite ultrahard tem um valor de 310 GPa quando testado com uma ponta fullerite. No entanto, o teste só funciona corretamente com uma ponta feita de material mais duro do que a amostra a ser testada. Isto significa que o verdadeiro valor fullerite ultrahard é provavelmente um pouco menor do que 310 GPa.
Diamantes cúbicos tem uma perfeita e fácil octahedral clivagem, o que significa que eles têm quatro aviões-indicações seguintes as faces do octaedro onde existem menos ligações e, portanto, pontos de fraqueza estrutural ao longo de-diamante que pode facilmente dividir (na sequência de um impacto brusco), deixando superfícies lisas. Do mesmo modo, a dureza do diamante é acentuadamente direccional: a direcção mais dura é a diagonal no cubo cara, 100 vezes mais difícil do que a direcção mais macio, que é a dodecaédrico avião. O plano octaédrica, seguido pelas direcções axiais no plano do cubo, são intermediários entre os dois extremos. O processo de corte do diamante depende muito dessa dureza direcional, pois sem ela um diamante seria quase impossível para a moda. Clivagem também desempenha um papel útil, especialmente em grandes pedras onde o cortador deseja remover o material defeituoso ou para produzir mais de uma pedra do mesmo pedaço de áspera.
Diamantes tipicamente cristalizar no cúbico sistema de cristal ( grupo espacial 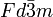 ) E consistem de tetraedro , ligado covalentemente átomos de carbono. Uma segunda forma chamado Lonsdaleite com simetria hexagonal também se encontra, mas é extremamente raro e é acreditado para formar apenas quando meteórica grafite cai para a Terra . O meio local de cada átomo é idêntica nas duas estruturas. Em termos de hábito de cristal, diamantes ocorrem mais freqüentemente como euhedral (bem-formado) ou arredondado e octahedra geminada, octahedra achatado conhecido como macles (com um contorno triangular). Outras formas incluem dodecahedra e (raramente) cubos. Existe alguma evidência de que intersticiais azoto impurezas desempenham um papel importante na formação de cristais euédricos-os diamantes maiores encontrados, tais como o Diamante Cullinan, ter sido totalmente desprovidas de massa. Estes diamantes são do tipo II e, portanto, contêm pouco ou nenhum nitrogênio (ver Composição e cor).
) E consistem de tetraedro , ligado covalentemente átomos de carbono. Uma segunda forma chamado Lonsdaleite com simetria hexagonal também se encontra, mas é extremamente raro e é acreditado para formar apenas quando meteórica grafite cai para a Terra . O meio local de cada átomo é idêntica nas duas estruturas. Em termos de hábito de cristal, diamantes ocorrem mais freqüentemente como euhedral (bem-formado) ou arredondado e octahedra geminada, octahedra achatado conhecido como macles (com um contorno triangular). Outras formas incluem dodecahedra e (raramente) cubos. Existe alguma evidência de que intersticiais azoto impurezas desempenham um papel importante na formação de cristais euédricos-os diamantes maiores encontrados, tais como o Diamante Cullinan, ter sido totalmente desprovidas de massa. Estes diamantes são do tipo II e, portanto, contêm pouco ou nenhum nitrogênio (ver Composição e cor).
Os rostos de octahedrons diamantes são altamente brilhante, devido à sua dureza; defeitos de crescimento, sob a forma de trigons ou poços etch estão freqüentemente presentes nas faces, sendo o primeiro fossas triangulares cujos pontos estão alinhados com as faces do octaedro. Um diamante fratura pode ser passo-like, conchoidal (shell-like, semelhante a vidro ) ou irregular. Diamantes que são quase rodada devido à tendência de intensificação octahedrons são encontrados geralmente revestidos no nyf, uma pele de goma-like; a combinação de faces escalonadas, defeitos de crescimento e nyf produz um "escamosa" ou aparência rugosa, e esses diamantes são rugas denominado. Um número significativo de diamantes cristalizam anhedrally: isto é, suas formas são tão distorcida que poucas faces cristalinas são discerníveis. Alguns diamantes encontrados no Brasil e na República Democrática do Congo são cryptocrystalline e ocorrem como opacas, de cor escura, esférico, massas radiais de minúsculos cristais; estes são conhecidos como ballas e são importantes para a indústria como lhes faltam os planos de clivagem de diamante de cristal único. Carbonado é um opaco semelhante forma microcristalina que ocorre em massas disformes. Como ballas diamante, carbonado carece de clivagem e sua gravidade específica varia muito, 2,9-3,5. Bort, diamantes encontrados no Brasil, Venezuela e Guiana , são o tipo mais comum de diamante industrial-grade, também criptocristalino ou de outra forma mal cristalizado, mas possuindo clivagem, translucidez e cores mais claras.
Devido à sua grande dureza e forte ligação molecular, um diamante de corte do facetas e arestas facetadas são visivelmente o mais plana e mais nítida. Um efeito colateral curioso da superfície perfeição do diamante é hidrofobia combinado com lipofilia. O ex-propriedade significa uma gota de água colocada em um diamante irá formar uma gota coerente, enquanto que na maioria dos outros minerais da água iria espalhar-se para cobrir a superfície. Da mesma forma, o diamante é excepcionalmente lipofílico, ou seja, graxa e óleo facilmente recolher na superfície de um diamante. Considerando que, em outros minerais petróleo iria formar gotas coerentes, em um diamante o óleo se espalhasse. Esta propriedade é explorada na utilização dos chamados "canetas de gorduras", que se aplicam uma linha de massa lubrificante para a superfície de um suspeito simulador de diamante.
O diamante é tão forte devido à forma os átomos de carbono fazer. É uma forma muito forte 3D, cada átomo de carbono possuindo quatro juntou-se a ele com ligações covalentes.
Dureza
Ao contrário de dureza, o que só indica a resistência ao risco, diamante de dureza ou tenacidade é justo bom. Dureza diz respeito à capacidade para resistir a ruptura de quedas ou impactos: devido à clivagem perfeita e fácil de diamante, é vulnerável a quebras. Um diamante vai quebrar se bater com um martelo comum.
Ballas e carbonado diamante são excepcionais, como são policristalino e, portanto, muito mais difícil do que o diamante de cristal único; eles são usados para bits de perfuração profunda e outras aplicações industriais exigentes. Cortes particulares de diamantes são mais propensos à ruptura-como marquês ou outros cortes que caracterizam cônicos pontos-e, portanto, pode ser seguráveis pelas companhias de seguros respeitáveis. O culet é uma faceta (paralelo ao quadro) dado ao pavilhão de diamantes lapidados projetados especificamente para reduzir a probabilidade de quebra ou fragmentação. Cintas extremamente finas ou muito finos também são propensos a muito maior quebra.
Cristais sólidos estranhos são comumente presente em diamante-essas e outras inclusões, tais como fraturas internas ou "penas" -pode comprometer a integridade estrutural de um diamante. Cortar diamantes que foram aprimorado para melhorar a sua clareza via enchimento copo de fraturas ou cavidades são especialmente frágeis, como o vidro não vai ficar até limpeza ultra-sônica ou os rigores da tocha do joalheiro. Diamantes cheia de fratura podem quebrar se tratada de forma inadequada.
Propriedades ópticas
O brilho de um diamante é descrito como "diamante", que significa simplesmente diamond-like. É o maior brilho possível bar que de metal (metálica), e é devido à dureza superlativo de diamante. Reflexões sobre as facetas de um diamante cortado corretamente são sem distorções, devido à sua planicidade. O índice de refracção de diamante (como medido através luz de sódio, 589,3 nm) é 2,417; porque é cúbica em estrutura, é também diamante isotrópico. Sua alta dispersão de 0,044 (intervalo BG) manifesta no fogo perceptível de diamantes lapidados. Este fogo-flashes de cores prismáticas visto em pedras transparentes-é talvez a mais importante propriedade óptica de diamante a partir de uma perspectiva de jóias. A proeminência ou quantidade de fogo visto em uma pedra é fortemente influenciado pela escolha de corte de diamante e suas proporções associadas (particularmente coroar altura), embora a cor do corpo de diamantes extravagantes podem esconder seu fogo em algum grau.
Alguns diamantes exposição fluorescência de várias cores e intensidades menores de onda longa (LW) de luz ultra-violeta (365 nm): Pedras da série do Cabo (Tipo Ia; ver composição e cor) geralmente apresentam fluorescência azul, e essas pedras podem também fosforescer amarelo. (Este é um estabelecimento único entre pedras preciosas). Outras cores de fluorescência LW possíveis são verde (geralmente em pedras marrons), amarelo, malva, ou vermelho (Tipo IIb). Em diamantes naturais normalmente há pouca ou nenhuma resposta a ondas curtas (SW) ultravioleta, mas o inverso é verdadeiro de produtos sintéticos. Alguns diamantes Tipo IIb naturais podem fosforescer azul após a exposição ao ultravioleta SW. Em naturais, fluorescência sob Raios-X é geralmente branco-azulado, amarelado ou verde. Alguns diamantes, especialmente diamantes canadenses, não mostram fluorescência.
Diamantes da série do Cabo tem uma visível espectro de absorção (como pode ser visto através de uma visão direta espectroscópio) que consiste em uma linha fina na violeta em 415,5 nm-entanto, esta linha é muitas vezes invisíveis até que o diamante tem sido arrefecido a temperaturas muito baixas. Associado a isso são as linhas mais fracas em 478 nm (muitas vezes apenas esta linha é visível), 465 nm, 452 nm, 435 nm, 423 nm e. Outras pedras mostrará faixas adicionais: marrom, verde, ou diamantes amarelos mostram uma banda no verde a 504 nm, por vezes acompanhada de duas bandas fracas adicionais em 537 nm e 495 nm. Digite diamantes IIb pode absorver no extremo vermelho, mas de outra forma não mostram espectro de absorção visível observável.
Laboratórios de gemologia fazer uso de máquinas espectrofotômetro que podem distinguir natural, artificial, e Color- diamantes reforçada. Os espectrofotômetros analisar o infravermelho, visível e ultravioleta espectros de absorção de diamantes arrefecido com nitrogênio líquido para detectar linhas diga-conto de absorção que normalmente não são perceptíveis.
Propriedades elétricas
Exceto para a maioria dos diamantes azuis naturais-que são semicondutores devido a substitucionais boro impurezas que substitui átomos de carbono-diamante é uma boa elétrica isolante. Diamantes azuis naturais recentemente recuperados a partir da mina de diamantes Argyle na Austrália foram encontrados para devem a sua cor a uma superabundância de hidrogênio átomos: estes diamantes não são semicondutores. Diamantes azuis naturais contendo boro e sintéticas diamantes dopado com boro são os semicondutores tipo p . Se um semicondutor do tipo n pode ser sintetizado, circuitos electrónicos pode ser fabricado a partir de diamante. Investigação a nível mundial está em andamento, com sucessos ocasionais relatados, mas nada de definitivo. Em 2002 , foi relatado no jornal Natureza que os pesquisadores conseguiram depositar um filme de diamante fina sobre uma superfície de diamante que é um passo importante para o fabrico de um chip de diamante. Em 2003 , foi relatado que NTT desenvolveu um dispositivo semicondutor de diamante. Em 2005 saiu relatórios que o Instituto Nacional de Ciência e Tecnologia Industrial (AIST) no Japão criou um diamante semicondutor do tipo n E um Light Emitting Diode ( Diodo emissor de luz) que produz a luz UV 235 nm.
Em abril de 2004 Nature relatou que abaixo da temperatura de transição supercondutora 4 K, diamante dopado com boro sintetizados a alta temperatura e alta pressão é um granel, tipo-II supercondutor . Em Outubro de 2004 supercondutividade foi encontrado para ocorrer em fortemente deposição de vapor químico assistida por plasma de micro-ondas de boro dopado (MPCVD) diamante abaixo da temperatura de transição supercondutora de 7,4 K .
Propriedades térmicas
Ao contrário da maioria isoladores eléctricos, o diamante é um bom condutor de calor devido à forte ligação covalente dentro do cristal. A maioria dos diamantes azuis naturais contêm boro que substituem átomos de átomos de carbono na matriz cristalina, e também têm uma elevada condutividade térmica. .999- 12 C diamante sintético monocristalino tem a maior a condutividade térmica de qualquer sólido, à temperatura ambiente conhecido: 2000-2500 W · m / m² · K (200-250 W · mm / cm² · K), cinco vezes mais do que o cobre . Porque o diamante tem alta condutividade térmica tal que já é utilizado na fabricação de semicondutores de silício para evitar e outros materiais semicondutores de superaquecimento. No menor temperaturas condutividade torna-se ainda melhor como o seu Elétrons Fermi pode coincidir com a modo de transporte normal phononic perto do Ponto Debye, e calor de transportes mais rapidamente, para superar a queda de calor específico com a menos quantal microestados, para chegar a 41.000 W · m / m² · K a 104 K. O mesmo diamante em .99999- 12 C está previsto para 200.000 W · m / m² · K (20 kW · mm / cm² · K).
Condutividade térmica do diamante é feito uso de por joalheiros e gemologists que podem empregar uma sonda térmica eletrônica para separar diamantes de suas imitações. Estas sondas consistem em um par de alimentado por bateria termistores montados em uma ponta de cobre fino. Um termistor funções como um dispositivo de aquecimento, enquanto as outras medidas a temperatura da ponta de cobre: se a pedra a ser testado é um diamante, que irão conduzir a energia térmica da ponta com rapidez suficiente para produzir uma queda de temperatura mensurável. Este teste leva cerca de 2-3 segundos. No entanto, as sondas mais antigas serão enganados por moissanite, uma imitação de diamante introduzido em 1998 , que tem uma condutividade térmica similar.
Sendo uma forma de carbono, eles podem queimar na presença de oxigênio se aquecido acima de 800 ° C (1500 ° F). Na ausência de oxigênio que pode suportar temperaturas mais altas, mas irá converter ao grafite eventualmente.
Composição, cor e estabilidade
Diamonds ocorrer em uma variedade de cores restrita-preto, marrom, amarelo, cinza, branco, azul, laranja, roxo ao rosa, vermelho e chartreuse. Os diamantes coloridos contêm defeitos cristalográficas, incluindo impurezas de substituição e defeitos estruturais, que causam a coloração. Teoricamente, os diamantes puros seria transparente e incolor. Os diamantes são cientificamente classificada em dois tipos principais e diversos subtipos, de acordo com a natureza dos defeitos atuais e como eles afetam a absorção de luz:
Tipo I diamante tem de azoto (N) átomos de como a impureza principal, a uma concentração de 0,1 por cento. Se os átomos de N estão em pares eles não afetam a cor do diamante; estes são Tipo IAA. Eles se os átomos de N estão em grandes agregados de numeração par conferir um amarelo a tonalidade marrom (Escreva IAB). Cerca de 98 por cento da Gem Diamonds são do tipo Ia, ea maioria destes são uma mistura de IAA e materiais IAB: estes diamantes pertencem à série do Cabo, nomeado após a região rica em diamantes anteriormente conhecido como Província do Cabo, na África do Sul , cujos depósitos são em grande parte tipo Ia. Se os átomos de N estão dispersos por todo o cristal em locais isolados (não emparelhado ou agrupados), eles dão a pedra uma intensa coloração amarela ou ocasionalmente marrom (tipo Ib); os diamantes canário raras pertencem a este tipo, o que representa apenas um Permille de diamantes naturais conhecidos. Diamante sintético contendo nitrogênio é Tipo Ib. Tipo I diamantes absorver tanto no infravermelho e ultravioleta região, a partir de 320 nm. Eles também têm uma característica de fluorescência e espectro de absorção visível (ver Propriedades ópticas ).
Diamantes do tipo II têm muito poucos se quaisquer impurezas de azoto. Escreva IIa diamante pode ser colorido rosa, vermelho, marrom ou devido a anomalias estruturais geradas por deformação plástica durante cristal crescimento a estes diamantes são raras (1,8 por cento da Gem Diamonds), mas constituem uma grande percentagem da produção australiana. Escreva diamantes IIb, que representam 0,1 por cento da Gem Diamonds, são geralmente um azul ou cinza aço devido ao boro espalhados dentro da matriz de cristal; estes diamantes também são semicondutores , ao contrário de outros tipos de diamante (ver Propriedades elétricas ). No entanto, uma superabundância de hidrogênio também pode dar uma cor azul; estes não são necessariamente Escreva IIb. Diamantes do tipo II absorver em uma região diferente do infravermelho, e transmitir no ultravioleta abaixo de 225 nm, ao contrário de diamantes Tipo I. Eles também têm diferentes características de fluorescência, mas não visíveis do espectro de absorção discernível.
Certo técnicas de aprimoramento de diamante são comumente usados para produzir artificialmente uma variedade de cores, incluindo azul, verde, amarelo, vermelho e preto. Técnicas de aprimoramento de cor geralmente envolvem irradiação, incluindo protões e deuteron bombardeio via ; cyclotrons nêutrons bombardeio através das pilhas de reatores nucleares; e eletrônica de bombardeio via Geradores de Van de Graaff. Estas partículas de alta energia alterar fisicamente o diamante de estrutura de cristal, batendo átomos de carbono fora do lugar e produzir centros de cor. A profundidade de penetração da cor depende da técnica e a sua duração, e, em alguns casos, o diamante pode ser deixado radioactivos em algum grau.
Deve-se notar que alguns diamantes irradiados são completamente naturais e um exemplo famoso é o Dresden Green Diamond. Nestes pedras naturais a cor é transmitida por "queimaduras de radiação", na forma de pequenas manchas, geralmente apenas superficial. Além disso, os diamantes Tipo IIa pode ter as suas deformações estruturais "reparados" através de um processo de alta temperatura e de alta pressão (HTHP), removendo grande parte ou todo de cor do diamante.
No final do século 18 , diamantes foram demonstrados para ser feito de carbono pelo experimento bastante caro de inflamar um diamante (por meio de um queima de vidro) em um oxigénio atmosfera e que mostra que gás de ácido carbónico ( dióxido de carbono ) foi o produto do combustão. O fato de que os diamantes são ursos combustíveis novo exame porque é relacionado a um fato interessante sobre diamantes. Os diamantes são carbono cristais que se formam nas profundezas da Terra sob altas temperaturas e pressões extremas. À pressão de ar na superfície (uma atmosfera), diamantes não são tão estáveis como grafite, e de modo que o decaimento de diamante é termodinamicamente favorável (δ H = -2 kJ / mol). Diamonds tinha sido mostrado previamente para queimar durante a época romana.
Assim, apesar Campanha de 1948 o anúncio da De Beers, os diamantes não são, definitivamente, para sempre. No entanto, devido a uma muito grande barreira de energia cinética, são os diamantes metaestável; eles não vão decair em grafite sob condições normais.
