
O cloreto de zinco
Sobre este escolas selecção Wikipedia
Crianças SOS, uma instituição de caridade educação , organizou esta selecção. Patrocinar uma criança para fazer uma diferença real.
| O cloreto de zinco | |
|---|---|
 | |
O cloreto de zinco | |
Outros nomes O zinco (II), cloreto de | |
| Identificadores | |
| Número CAS | 7646-85-7 |
| Número RTECS | ZH1400000 |
| Propriedades | |
| Fórmula molecular | ZnCl2 |
| Massa molar | 136,315 g / mol |
| Aparência | Sólido cristalino branco. |
| Densidade | 2,907 g / cm³, sólido |
| Ponto de fusão |
275 ° C (548 K) |
| Ponto de ebulição | 756 ° C (1.029 K) |
| Solubilidade em água | 432 g / 100 ml (25 ° C) |
| Estrutura | |
| A estrutura de cristal | Quatro formas conhecidas Hexagonal repleto de perto (δ) é a única forma estável quando anidro. |
| Coordenação geometria | Tetrahedral , 4-coordenar, linear na fase gasosa. |
| Perigos | |
| MSDS | MSDS External |
| Classificação da UE | Irritante (I), Corrosivo (C). |
| Frases R | R34, R50, R53 |
| Frases-S | S7 / 8, S28, S45, S60, S61 |
| Os compostos relacionados | |
| Outros aniões | Fluoreto de zinco, brometo de zinco, iodeto de zinco |
| Outros cátions | O cobre (II), cloreto , cloreto de cádmio |
| Excepto quando indicado, os dados são dados para materiais no seu estado normal (a 25 ° C, 100 kPa) | |
| Referências de Infobox | |
O cloreto de zinco é o nome do composto químico com a fórmula Zn Cl 2 e os seus hidratos. Cloretos de zinco, dos quais nove formas cristalinas são conhecidas, são incolores ou branca e altamente solúvel em água. ZnCl2 em si é higroscópico e até mesmo deliquescente. As amostras devem ser protegidos contra as fontes de humidade, incluindo o vapor de água presente no ar ambiente. Cloreto de zinco encontra ampla aplicação em têxteis de processamento, fluxos metalúrgicos e síntese química.
Estrutura e propriedades básicas
Quatro formas cristalinas, chamadas polimorfos, de ZnCl 2 são conhecidos, e em cada caso, os iões Zn2 + são tetraedricamente coordenado a quatro ligandos de cloreto. O arrefecimento rápido do fundido ZnCl 2 dá um vidro, ou seja, um sólido amorfo rígida. Adicionalmente ZnCl 2 formas hidratos e pelo menos um hidróxido misto, ZnClOH.
O carácter covalente é do material anidro é indicada pelo seu relativamente baixo ponto de fusão de 275 ° C. Mais evidências para a covalência é fornecido pela alta solubilidade do dicloreto em etéreos tais como solventes, em que se forma aductos com a fórmula ZnCl 2 L 2, onde G = ligando, tal como O (C 2 H 5) 2. Consistente com a Acidez de Lewis de Zn 2+, soluções aquosas de ZnCl 2 são soluções ácidas: um 6 Solução aquosa M tem um pH de 1.
Quatro hidratos de cloreto de zinco são conhecidas. ZnCl 2 (H2O) 4 cristaliza a partir de soluções aquosas de cloreto de zinco. Também são caracterizados ZnCl 2 (H2O) n em que n = 1, 1,5, 2,5, e 3. Quando o cloreto de zinco hidratado é aquecida, obtém-se um resíduo de ZnOHCl.
Em solução aquosa, o cloreto de zinco dissocia totalmente em Zn 2+. Assim, embora muitos sais de zinco têm diferentes fórmulas e diferente estruturas cristalinas, estes sais se comportam de forma muito semelhante em solução aquosa. Por exemplo, as soluções preparadas a partir de qualquer um dos polimorfos de ZnCl 2, bem como outros halogenetos (brometo, iodeto) e o sulfato podem muitas vezes ser utilizados alternadamente para a preparação de outros compostos de zinco. Ilustrativa é a preparação de carbonato de zinco:
- ZnCl2 ( aq) + Na 2 CO 3 (aq) → ZnCO 3 (s) + 2 NaCl (aq)
Preparação e purificação
ZnCl2 anidro pode ser preparado a partir de zinco e cloreto de hidrogénio.
- Zn + 2 HCl → ZnCl2 + H 2
As formas hidratadas e soluções aquosas podem ser facilmente preparados por tratamento de peças de Zn metálico com ácido clorídrico concentrado. O óxido de zinco e sulfureto de zinco reage com HCl:
Ao contrário de muitos outros elementos, zinco existe essencialmente em apenas um estado de oxidação, 2+, o que simplifica a purificação.
Amostras comerciais de cloreto de zinco normalmente contêm água e produtos de produto de hidrólise. Tais amostras podem ser purificado por extracção em quente dioxano, que é filtrada a quente e o filtrado é arrefecido para dar um precipitado de ZnCl2. Amostras anidras pode ser purificado por sublimação numa corrente de Gás cloreto de hidrogénio, seguido por aquecimento a 400 ° C numa corrente de seco azoto gás. Finalmente, o método mais simples baseia-se tratar o cloreto de zinco com cloreto de tionilo.
Aplicações
Como um fluxo metalúrgico
O cloreto de zinco tem a capacidade de atacar óxidos metálicos (MO) para dar derivados de fórmula MZnOCl 2. Esta reacção é relevante para o utilitário de ZnCl2 como um fluxos para solda - se dissolve revestimentos de óxido expondo a superfície de metal limpa. Tipicamente este fluxo foi preparada por dissolução de folha de zinco em diluída de ácido clorídrico até que o líquido deixado evoluir de hidrogénio; por esta razão, tal fluxo já foi conhecida como espíritos mortos . Devido à sua natureza corrosiva, este fluxo não é adequado para situações em que qualquer resíduo não pode ser limpo de distância, tais como trabalho electrónico. Esta propriedade também leva à sua utilização no fabrico de magnésia cimentos para obturações dentárias e certa colutórios como um ingrediente activo.
Na síntese orgânica
No laboratório, o cloreto de zinco encontra ampla utilização, principalmente como uma força moderada Ácido de Lewis. Ele pode catalisar (A) a Síntese de índole de Fischer, e também (B) Reacções de acilação de Friedel-Crafts envolvendo activada anéis aromáticos
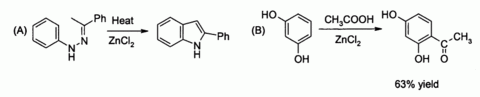
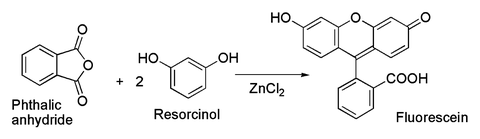
Relacionado com a última, é a preparação clássica do corante fluoresceína de anidrido ftálico e resorcinol, que envolve um Acilação de Friedel-Craf ts. Esta transformação tem de facto sido realizada utilizando o mesmo hidratado amostra ZnCl2 mostrado na imagem acima.
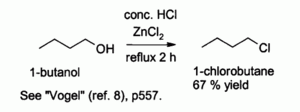
O ácido clorídrico reage mal sozinho com álcoois primários e de álcoois secundários , mas uma combinação de HCl com ZnCl2 (conhecidos em conjunto como o " Lucas reagente ") é eficaz para a preparação de cloretos de alquilo. As reacções típicas são realizadas a 130 ° C. Esta reacção prossegue via um provavelmente S N 2 com mecanismo de álcoois primários mas S N 1 via com álcoois secundários.
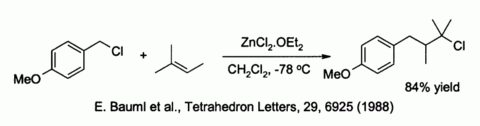
O cloreto de zinco também activa benz�ica e halogenetos alílicos direção substituição por fraco nucleófilos, tais como alcenos :
De modo semelhante, ZnCl2 promove selectiva De NaBH 3 CN a redução de halogenetos terciários, alílicos ou benzílicos correspondentes aos hidrocarbonetos.
O cloreto de zinco é também um reagente de partida úteis para a síntese de muitos reagentes organo-zinco, tal como os utilizados na catalizada por paládio Acoplamento Negishi com halogenetos de arilo ou halogenetos de vinilo. Em tais casos, o composto de organo zinco é geralmente preparado pela a partir de uma transmetalação ou um organolítio Reagente de Grignard, por exemplo:
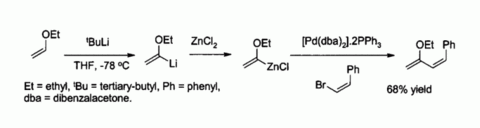
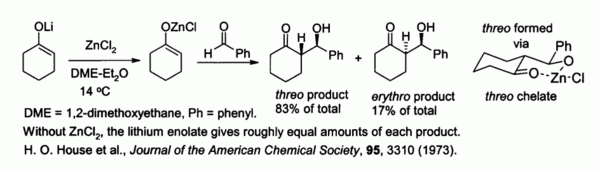
Zinco enolatos, preparado a partir de enolatos de metais alcalinos e de ZnCl2, fornecer controlo de estereoquímica reacções aldol de condensação devido a quelação para o zinco. No exemplo mostrado abaixo, o threo produto foi favorecida em detrimento de eritro por um factor de 5: 1 quando ZnCl2 em DME / éter foi usada. O quelato é mais estável quando o grupo fenilo é volumoso pseudo equatorial ao invés de pseudo axial, ou seja, em vez de eritro treo.
Em processamento de têxteis
As soluções aquosas concentradas de cloreto de zinco (mais de 64% de cloreto de zinco em peso / peso em água) têm a propriedade interessante de dissolver amido, seda, e celulose. Assim, estas soluções não podem ser filtrados através de papéis de filtro padrão. Relevante para a sua afinidade para estes materiais, ZnCl2 é usado como um agente à prova de fogo e em tecido refresheners "", tais como Febreze
Considerações sobre segurança
Os sais de zinco são relativamente não-tóxico. Precauções que se aplicam a ZnCl anidro 2 são aplicáveis às outras halogenetos de metal anidro, isto é, hidrólise pode ser exotérmica e contato devem ser evitados. As soluções concentradas são ácidas e corrosivo e atacam especificamente celulose e seda como Ácidos de Lewis. Ver FISPQ na tabela.
