
Lanthane
Renseignements généraux
Enfants SOS bénévoles ont aidé à choisir des articles et faites autre matériel de programme de parrainage d'enfants SOS est cool!
| Lanthane | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
57 La | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||
blanc argenté  | ||||||||||||||||||||||||||||
| Propriétés générales | ||||||||||||||||||||||||||||
| Nom, symbole, nombre | lanthane, La, 57 | |||||||||||||||||||||||||||
| Prononciation | / l æ n θ ən əm / | |||||||||||||||||||||||||||
| Catégorie Metallic | lanthanides parfois considéré comme un métal de transition | |||||||||||||||||||||||||||
| Groupe, période, bloc | n / a, 6, fa | |||||||||||||||||||||||||||
| Poids atomique standard | 138,90547 | |||||||||||||||||||||||||||
| Configuration électronique | [ Xe ] 5d 6s 1 2 2, 8, 18, 18, 9, 2 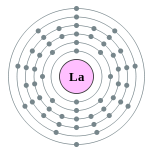 | |||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||
| Découverte | Carl Gustaf Mosander (1838) | |||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||
| Densité (à proximité rt) | 6,162 g · cm -3 | |||||||||||||||||||||||||||
| Liquid densité au mp | 5,94 g · cm -3 | |||||||||||||||||||||||||||
| Point de fusion | 1193 K , 920 ° C, 1688 ° F | |||||||||||||||||||||||||||
| Point d'ébullition | 3737 K, 3464 ° C, 6267 ° F | |||||||||||||||||||||||||||
| La chaleur de fusion | 6,20 kJ · mol -1 | |||||||||||||||||||||||||||
| Chaleur de vaporisation | 402,1 kJ · mol -1 | |||||||||||||||||||||||||||
| Capacité thermique molaire | 27,11 J · mol -1 · K -1 | |||||||||||||||||||||||||||
| Pression de vapeur (extrapolée) | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||
| États d'oxydation | 3, 2 (fortement oxyde de base) | |||||||||||||||||||||||||||
| Électronégativité | 1,10 (échelle de Pauling) | |||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 538,1 kJ · mol -1 | |||||||||||||||||||||||||||
| 2ème: 1067 kJ · mol -1 | ||||||||||||||||||||||||||||
| 3ème: 1850,3 kJ · mol -1 | ||||||||||||||||||||||||||||
| Rayon atomique | 187 h | |||||||||||||||||||||||||||
| Rayon covalente | 207 ± 20 heures | |||||||||||||||||||||||||||
| Miscellanées | ||||||||||||||||||||||||||||
| Crystal structure | hexagonal  | |||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | |||||||||||||||||||||||||||
| Résistivité électrique | ( rt) (α, poly) 615 nΩ · m | |||||||||||||||||||||||||||
| Conductivité thermique | 13,4 W · m -1 · K -1 | |||||||||||||||||||||||||||
| Dilatation thermique | ( rt) (α, poly) 12,1 um / (m · K) | |||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 2,475 m · s -1 | |||||||||||||||||||||||||||
| Le module d'Young | (Formulaire de α) 36,6 GPa | |||||||||||||||||||||||||||
| Module de cisaillement | (Formulaire de α) 14,3 GPa | |||||||||||||||||||||||||||
| Module Bulk | (Formulaire de α) 27,9 GPa | |||||||||||||||||||||||||||
| Coefficient de Poisson | (Formulaire de α) 0,280 | |||||||||||||||||||||||||||
| Dureté Mohs | 2,5 | |||||||||||||||||||||||||||
| Dureté Vickers | 491 MPa | |||||||||||||||||||||||||||
| Dureté Brinell | 363 MPa | |||||||||||||||||||||||||||
| Numéro de registre CAS | 7439-91-0 | |||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||
| Article détaillé: Isotopes de lanthane | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Le lanthane est un élément chimique avec le symbole La et de numéro atomique 57. Le lanthane est un élément métallique blanc argenté qui appartient au groupe 3 du tableau périodique et est le premier élément du lanthanide série. On le trouve dans certains minerais de terres rares, généralement en combinaison avec le cérium et d'autres éléments de terres rares. Lanthane est un, ductile et malléable métal mou qui se oxyde rapidement lorsqu'ils sont exposés à l'air. Il est produit à partir des minéraux monazite et bastnäsite l'aide d'un procédé d'extraction à plusieurs étages complexe. composés de lanthane ont de nombreuses applications en tant que catalyseurs, additifs en verre, l'éclairage de carbone pour l'éclairage de studio et de la projection, les éléments d'allumage dans des briquets et des torches, cathodes d'électrons, scintillateurs, et autres. Le carbonate de lanthane (La 2 (CO 3) 3) a été approuvé comme médicament contre insuffisance rénale.
Propriétés
Propriétés physiques
Lanthane est un, malléable, métal blanc argenté mou qui a structure cristalline hexagonale à la température ambiante. A 310 ° C, les variations de lanthane à un face-centrée structure cubique, et au 865 ° C dans un corps-centré structure cubique. Lanthane est facilement oxydé (un échantillon de un centimètre complètement oxyder dans l'année) et est donc utilisé sous forme élémentaire uniquement à des fins de recherche. Par exemple, les atomes de lanthane simples ont été isolés en leur implantation dans molécules de fullerène. Si les nanotubes de carbone sont remplis de ces fullerènes de lanthane-encapsulé et recuits, nanochains métalliques de lanthane sont produites à l'intérieur de nanotubes de carbone.
Propriétés chimiques
Lanthane présente deux états d'oxydation, 3 et 2, l'ancien étant beaucoup plus stable. Par exemple, LaH 3 est plus stable que LaH 2. brûlures de lanthane facilement à 150 ° C pour former lanthane (III) de l'oxyde:
- 4 La + 3 O 2 → 2 La 2 O 3
Cependant, lorsqu'il est exposé à de l'air humide à la température ambiante, l'oxyde de lanthane formant un oxyde hydraté avec une grande augmentation de volume.
Lanthane est assez électropositifs et réagit lentement avec l'eau froide et assez rapidement avec de l'eau chaude pour former hydroxyde de lanthane:
- La 2 (s) + 6 H 2 O (l) 2 → La (OH) 3 (aq) + 3 H 2 (g)
Le lanthane métal réagit avec tous les halogènes. La réaction est effectuée si vigoureuse supérieure à 200 ° C:
- La 2 (s) + 3 F 2 (g) → 2 LaF 3 (s)
- La 2 (s) + 3 Cl2 (g) → 2 LaCl3 (s)
- 2 La (s) + 3 Br 2 (g) → 2 LaBr 3 (s)
- La 2 (s) + 3 I 2 (g) → 2 Lal 3 (s)
Le lanthane se dissout facilement dans diluée d'acide sulfurique pour former des solutions contenant les ions de La (III), qui existent en tant que [La (OH 2)] 9 3+ complexes:
- 2 La (s) + 3 H 2 SO 4 (aq) → 2 La 3+ (aq) + 3 SO 2-
4 (aq) + 3 H 2 (g)
Le lanthane se combine avec l'azote, le carbone, le soufre, le phosphore, le bore, le sélénium, le silicium et l'arsenic à des températures élevées, en formant des composés binaires. La configuration électronique du incolore ions La 3+ est [Xe] 4f 0.
Isotopes
Naturellement lanthane se produisant est composé d'une écurie (139 La) et une radioactif (138 La) isotopes , avec l'isotope stable, 139 La, étant le plus abondant (99,91% abondance naturelle). 38 des radio-isotopes ont été caractérisés par le plus stable étant 138 La avec une demi-vie de 1,05 × 10 11 ans, 137 de La, avec une demi-vie de 60000 ans. La plupart des isotopes radioactifs restants ont des demi-vies qui sont moins de 24 heures, et la majorité d'entre eux ont des demi-vies de moins de 1 minute. Cet élément a aussi trois méta-Unis.
Les isotopes de lanthane varient en poids atomique à partir de 117 u (117 La) à 155 u (155 La).
Histoire
Le mot vient du lanthane λανθανω grec [] = lanthanō se tenir caché. Lanthane a été découvert en 1839 par Suédois chimiste Carl Gustav Mosander, quand il décompose partiellement un échantillon de nitrate de cérium par chauffage et traitement du sel résultant avec une solution diluée d'acide nitrique . De la solution résultante, il a isolé une nouvelle terre rare qu'il appelle lantana. Lanthane a été isolé sous forme relativement pure en 1923.
Lanthane est le plus fortement basique de tous les lanthanides trivalents, et cette propriété est ce qui a permis Mosander pour isoler et purifier les sels de cet élément. la séparation de basicité que exploité commercialement impliqué la précipitation fractionnée des bases plus faibles (comme didyme) de la solution de nitrate par addition d'oxyde de magnésium ou diluer le gaz ammoniac. Lanthane purifié est resté en solution. (Les méthodes de basicité étaient uniquement pour la purification de lanthane; didyme ne pouvait pas être efficacement encore séparé de cette manière.) L'autre technique de cristallisation fractionnée a été inventé par Dmitri Mendeleev , sous la forme de la double tétrahydraté de nitrate d'ammonium, qu'il sert à séparer lanthane moins soluble de la didymium plus soluble dans les années 1870. Ce système a été utilisé dans le commerce dans la purification de lanthane jusqu'à ce que le développement de méthodes d'extraction par solvant pratiques qui ont commencé à la fin des années 1950. (Un processus détaillé en utilisant la double nitrates d'ammonium pour fournir 99,99% de lanthane pur, les concentrés de néodyme et de praséodyme concentrés sont présentés dans Callow 1967, à un moment où le processus est en train de devenir obsolète.) Comme utilisé pour la purification de lanthane, les doubles nitrates d'ammonium ont été recristallisés dans de l'eau. Lorsque, plus tard adapté par Carl Auer Von Welsbach pour la scission de didyme, l'acide nitrique a été utilisé comme solvant pour abaisser la solubilité du système. Lanthane est relativement facile à purifier, car il ne dispose que d'un lanthanide adjacente, le cérium, qui se est très facilement éliminé en raison de son tétravalence potentiel.
La purification par cristallisation fractionnée du lanthane comme le nitrate double d'ammonium est suffisamment rapide et efficace, qui lanthane purifié de cette manière ne était pas cher. La Division des produits chimiques Lindsay de Potash américain et Chemical Corporation, pour un temps le plus grand producteur de terres rares dans le monde, dans une liste de prix daté du 1er Octobre, 1958 au prix de 99,9% de nitrate de lanthane d'ammonium (de teneur en oxyde de 29%) à 3.15 $ la livre , ou $ 1,93 par livre en quantités de 50 livres. L'oxyde correspondant (un peu plus pur à 99,99%) a été au prix de $ 11,70 ou $ 7,15 par livre pour les deux gammes de quantités. Le prix pour leur grade le plus pur d'oxyde (99,997%) était de 21,60 $ et $ 13,20, respectivement.
Occurrence

Bien que le lanthane est classé dans le groupe d'éléments appelés des métaux des terres rares, il ne est pas rare du tout. Lanthane est disponible en quantités relativement importantes (32 ppm dans la croûte de la Terre). "terres rares" ont obtenu leur nom parce qu'ils étaient vraiment très rare par rapport aux terres «communes» tels que la chaux ou de la magnésie, et historiquement seulement quelques dépôts étaient connus. Lanthane est pris en considération comme un métal de terre rare parce que le processus de la mienne est difficile, longue et coûteuse.
Monazite (Ce, La, Th, Nd, Y) PO 4, et bastnäsite (Ce, La, Y) CO 3 F, sont les principaux minerais dans lesquels le lanthane est présent, en pourcentage allant jusqu'à 25 à 38 pour cent de la teneur totale des lanthanides. En général, il est plus lanthane dans bastnäsite que dans la monazite. Jusqu'en 1949, bastnäsite était un minéral rare et obscure, pas même à distance envisagé comme une source commerciale potentielle pour les lanthanides. Cette année, le grand dépôt à la Mine de Mountain Pass en Californie a été découvert. Cette découverte a alerté les géologues de l'existence d'une nouvelle classe de gisement de terres rares, portant la terre rare carbonatites, d'autres exemples de ce qui bientôt apparus, en particulier en Afrique et en Chine.
Production
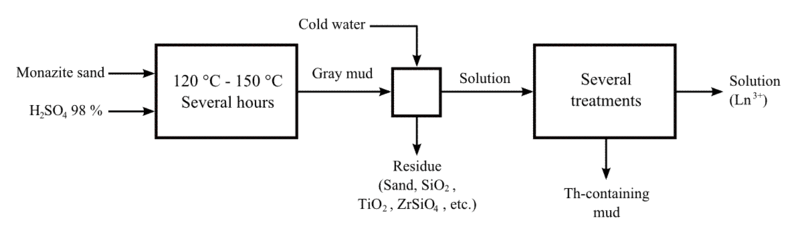
Lanthane est le plus souvent obtenu à partir de monazite et bastnäsite. Les mélanges minéraux sont concassés et broyés. Monazite, en raison de ses propriétés magnétiques, peut être séparé par une séparation électromagnétique répété. Après la séparation, elle est traitée avec concentrée chaude d'acide sulfurique pour produire des sulfates de terres rares soluble dans l'eau. Les filtrats acides sont partiellement neutralisés avec de l'hydroxyde de sodium à pH 4.3. thorium précipite dans la solution sous forme d'hydroxyde et est enlevée. Après cela, la solution est traitée avec l'oxalate d'ammonium pour convertir les terres rares à leur insoluble oxalates. Les oxalates sont convertis en oxydes par recuit. Les oxydes sont dissous dans de l'acide nitrique qui exclut l'un des principaux composants, le cérium , dont l'oxyde est insoluble dans HNO 3. Le lanthane est séparé comme un sel double de nitrate d'ammonium par cristallisation. Ce sel est relativement moins soluble que les autres sels doubles de terres rares et reste donc dans le résidu.
La routine de séparation la plus efficace pour le sel de lanthane à partir de la solution de sel de terre rare est, cependant, l'échange d'ions. Dans ce procédé, les ions de terres rares sont adsorbés sur la résine échangeuse d'ions appropriée, par échange avec de l'hydrogène, l'ammonium ou des ions cuivriques présents dans la résine. Les ions de terre rare sont ensuite lavées de façon sélective par un agent complexant approprié, tel que le citrate d'ammonium ou le nitrilotriacétate. Le lanthane peut également être séparé de la solution de nitrates de terres rares par extraction liquide-liquide avec un liquide organique approprié, tel que le tributyl phosphalate. Actuellement, l'agent d'extraction le plus couramment utilisé pour la purification de lanthane et les autres lanthanides est l'ester 2-éthylhexylique de l'acide 2-ethylhexylphosphonic; ce qui a de meilleures caractéristiques de manipulation que le phosphate de bis-2-éthylhexyle préalablement utilisé.
Le lanthane métal est obtenu à partir de son oxyde par chauffage avec le chlorure d'ammonium ou le fluorure et d'acide fluorhydrique à 300-400 ° C pour produire le chlorure ou le fluorure:
- La 2 O 3 + 6 NH 4 Cl → 2 LaCl 3 + 6 NH 3 + 3 H 2 O
Ceci est suivi par une réduction avec des métaux alcalins ou alcalino-terreux dans le vide ou une atmosphère d'argon:
- LaCl 3 + 3 Li → La 3 + LiCl
De plus, le lanthane pur peut être produit par électrolyse de mélange fondu de LaCl 3 anhydre NaCl ou KCl et à des températures élevées.
Applications

La première application historique de lanthane était lanterne de gaz manteaux. Carl Auer Von Welsbach utilisé un mélange de 60% l'oxyde de magnésium, 20% oxyde de lanthane et 20% oxyde d'yttrium qu'il a appelé Actinophor, et breveté en 1885. Les manteaux originaux donné le feu vert teinté et ne étaient pas très réussie, et sa première société, qui a établi une usine en Atzgersdorf en 1887, a échoué en 1889.
Utilisations modernes de lanthane comprennent:

- Un matériau utilisé pour matériau anodique de des batteries hybrides nickel-métal est La (Ni 3,6 Mn 0,4 Al 0,3 Co 0,7. En raison de leur coût élevé pour extraire les autres lanthanides une mischmetal avec plus de 50% de lanthane est utilisé au lieu de lanthane pur. Le composé est un composant intermétallique du type AB 5.
Comme la plupart des voitures hybrides utilisent batteries nickel-hydrure métallique, des quantités massives de lanthane sont nécessaires pour la production de voitures hybrides. Une batterie d'automobile hybride typique pour un Toyota Prius nécessite de 10 à 15 kg (22-33 lb) de lanthane. Comme ingénieurs poussent la technologie pour augmenter la consommation de carburant, deux fois ce montant du lanthane pourrait être tenu par véhicule.
- Alliages hydrogène éponge peuvent contenir lanthane. Ces alliages sont capables de stocker jusqu'à 400 fois leur propre volume de gaz d'hydrogène dans un procédé d'adsorption réversible. L'énergie thermique est libérée à chaque fois qu'ils le font; par conséquent, ces alliages ont des possibilités dans les systèmes de conservation de l'énergie.
- Mischmétal, un pyrophorique alliage utilisé des pierres à feu, contient 25% à 45% de lanthane.
- oxyde de lanthane et le borure sont utilisés sous forme électronique les tubes à vide comme matériaux de cathode chaud avec une forte émissivité électrons . Cristaux de LaB 6 sont utilisés dans une grande luminosité, durée de vie prolongée, les sources d'émission d'électrons pour thermioniques microscopes électroniques et Propulseurs à effet Hall.
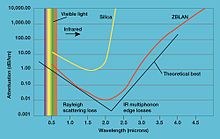
- Fluorure de lanthane (LaF 3) est une composante essentielle d'un verre de fluorure lourde nommée ZBLAN. Ce verre a la transmittance supérieure dans le domaine de l'infrarouge et est donc utilisé pour les systèmes de communication par fibre optique.
- Cérium dopé le bromure de lanthane et le chlorure de lanthane sont les inorganique récent scintillateurs qui ont une combinaison de rendement lumineux élevé, meilleure résolution de l'énergie et une réponse rapide. Leur haut rendement convertit en résolution en énergie supérieure; En outre, la sortie de lumière est très stable et relativement élevé sur une très large gamme de températures, ce qui rend particulièrement intéressante pour les applications à haute température. Ces scintillateurs sont déjà largement utilisés commercialement dans les détecteurs de neutrons ou les rayons gamma.
- Les lampes à arc de carbone utilisent un mélange d'éléments des terres rares pour améliorer la qualité de la lumière. Cette application, en particulier par la Motion Picture l'industrie pour l'éclairage de studio et de projection, a consommé environ 25% des composés de terres rares produites jusqu'à la phase de lampes à arc de carbone.
- Le lanthane (III) oxyde (La 2 O 3) améliore la résistance aux alcalis de verre , et est utilisé dans la fabrication des verres optiques spéciaux, tels que le verre absorbant le rayonnement infrarouge, ainsi que caméra et télescope lentilles, en raison de la haute indice de réfraction et une faible dispersion de lunettes de terres rares. oxyde de lanthane est également utilisé comme additif de croissance des grains lors de la phase liquide frittage de nitrure de silicium et diborure de zirconium.
- De petites quantités de lanthane ajouté à l'acier améliore son malléabilité, résistance aux chocs et ductilité. Considérant que l'addition de lanthane de molybdène diminue sa dureté et sa sensibilité aux variations de température.
- De petites quantités de lanthane sont présents dans de nombreux produits de la piscine pour éliminer les phosphates qui nourrissent les algues.
- Oxyde de lanthane additif de tungstène est utilisé dans tungstène arc de gaz de soudage des électrodes, en tant que substitut pour radioactive du thorium .
- Divers composés de lanthane et d'autres éléments des terres rares (oxydes, chlorures, etc.) sont des composants de catalyse divers, tels que le craquage du pétrole des catalyseurs .
- Le lanthane-baryum datation radiométrique est utilisé pour estimer l'âge des roches et minerais, si la technique a limité popularité.
- Le carbonate de lanthane a été approuvé comme médicament (Fosrenol, Shire Pharmaceuticals) pour absorber l'excès phosphate en cas de au stade terminal de l'insuffisance rénale.
- fluorure de lanthane est utilisé dans les revêtements de lampes de phosphore. Mélangé avec du fluorure d'europium, il est également appliqué à la membrane cristalline du électrodes sélectives d'ions fluorure.
- Comme la peroxydase de raifort, de lanthane est utilisé comme un traceur opaque aux électrons en biologie moléculaire.
- Lanthane bentonite modifié (ou Phoslock) est utilisé pour éliminer les phosphates de l'eau dans les traitements des lacs
Rôle biologique
Lanthane a pas connu rôle biologique. L'élément est très mal absorbé après administration orale et quand injecté son élimination est très lente. Le carbonate de lanthane a été approuvé comme médicament nommé Fosrenol pour absorber l'excès phosphate dans les cas d'insuffisance rénale au stade terminal.
Bien que le lanthane a des effets pharmacologiques sur plusieurs récepteurs et canaux ioniques, sa spécificité pour le récepteur GABA est unique parmi les cations divalents. Lanthane agit sur le même site sur le modulateur récepteur GABA comme un négatif de zinc connu modulateur allostérique. Le cation lanthane La 3+ est un modulateur allostérique positif au niveau des récepteurs de GABA native et recombinante, augmenter le temps de canal ouvert et en diminuant la désensibilisation d'une manière dépendant de la configuration de sous-unité.
Précautions
Lanthane a un faible niveau de toxicité à modérée et doit être manipulé avec soin. Chez l'animal, l'injection de solutions de lanthane produit l'hyperglycémie, une faible pression artérielle, de la dégénérescence rate et altérations hépatiques. L'application à la lumière de l'arc de carbone conduit à l'exposition des personnes aux rares oxydes d'éléments des terres et des fluorures, conduit parfois à pneumoconiose.
Livres
- La Chimie Industrielle de l'lanthanides, l'yttrium, thorium et l'uranium, par RJ Callow, Pergamon Press 1967
- Métallurgie extractive de terres rares, par CK Gupta et N. Krishnamurthy, CRC Press 2005
- Nouveau Traité de Chimie Minérale, Vol. VII. Scandium, l'yttrium, éléments des Terres Rares, Actinium, P. Pascal, éditeur, Masson & Cie 1959
- Chimie des lanthanides, par RC Vickery, Butterworths 1953
