
Strontium
Saviez-vous ...
SOS Enfants, qui se déroule près de 200 sos écoles dans le monde en développement, a organisé cette sélection. Un lien rapide pour le parrainage d'enfants est http://www.sponsor-a-child.org.uk/
| Strontium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
38 Sr | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
métallique blanc argenté  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | strontium, Sr, 38 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / s t r ɒ n ʃ ⁱ ə m / -sh STRON (ee) -əm; / s t r ɒ n t Je ə m / STRON -tee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Élément Catégorie | métal alcalino-terreux | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 2 (métaux alcalino-terreux) , 5, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 87,62 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Kr ] 5s 2 2, 8, 18, 8, 2 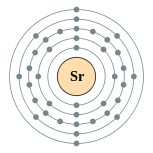 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | William Cruickshank (1787) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Humphry Davy (1808) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 2,64 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 2,375 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1050 K , 777 ° C, 1431 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 1655 K, 1382 ° C, 2520 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 7,43 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 136,9 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 26,4 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 2, 1 (fortement oxyde de base) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 0,95 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 549,5 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1064,2 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 4138 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 215 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 195 ± 22 heures | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 249 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique à faces centrées  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 132 nΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 35,4 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 22,5 um · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 15,7 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 6,03 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,28 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-24-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de strontium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Strontium (pron .: / s t r ɒ n t Je ə m / STRON -tee-əm) est un élément chimique avec le symbole Sr et de numéro atomique 38. Un métal alcalino-terreux , le strontium est un élément métallique blanc argenté ou jaunâtre souple qui est hautement réactif chimiquement. Le métal devient jaune lorsqu'il est exposé à l'air. Le strontium possède des propriétés physiques et chimiques semblables à ses deux voisins calcium et le baryum. Il se produit naturellement dans les minerais celestine et strontianite. Bien strontium naturel est stable, la synthétique 90 Sr isotopique est présent dans radioactif retombées et a une demi-vie de 28,90 années.
Les deux strontium et strontianite sont nommés d'après Strontian, un village en Ecosse près de laquelle le minéral a été découvert en 1790 par Adair Crawford et William Cruickshank. La production de sucre de betterave à sucre était au 19ème siècle la plus grande application. Les composés du strontium sont aujourd'hui principalement utilisés pour la production de tubes à rayons cathodiques. Le déplacement de tubes cathodiques par d'autres méthodes d'affichage dans les postes de télévision est en train de changer la consommation globale.
Caractéristiques

Le strontium est un métal gris argenté qui est plus molle que du calcium et encore plus réactifs vis- eau , avec lequel il réagit au contact de produire hydroxyde de strontium et de l'hydrogène gazeux. Il brûle dans l'air pour produire à la fois l'oxyde de strontium et strontium nitrure, mais étant donné qu'il ne réagit pas avec l'azote au-dessous de 380 ° C, à la température ambiante il ne former l'oxyde spontanément. Trois allotropes de strontium métallique existent, avec points de transition à 235 et 540 ° C.
En raison de sa réactivité extrême de l'oxygène et de l'eau, cet élément ne se produit naturellement dans les composés avec d'autres éléments, tels que les minéraux strontianite et célestine. Elle est maintenue sous un hydrocarbure liquide, tel que une huile minérale ou kérosène pour prévenir oxydation; fraîchement exposée métal de strontium tourne rapidement un couleur jaunâtre avec la formation de l'oxyde. Finement strontium poudre métallique est signifie pyrophore qu'elle se enflamme spontanément dans l'air à la température ambiante. Sels de strontium volatils confèrent un brillant couleur rouge à flammes , et ces sels sont utilisés dans pyrotechnie et dans la production de fusées. Strontium naturel est un mélange de quatre stables isotopes .
Histoire
Le strontium est nommé d'après le village écossais de Strontian (gaélique Sron un t-Sithein), ayant été découvert dans les minerais extraits des mines de plomb là. En 1790, Adair Crawford, un médecin engagé dans la préparation de baryum, et son collègue William Cruickshank, a reconnu que les minerais Strontian présentaient des propriétés différentes de celles normalement vu dans d'autres "sources" espars lourds. Cela a permis de conclure Adair à la page 355 "... il est probable en effet, que le minéral scotch est une nouvelle espèce de terre qui n'a pas jusqu'ici été suffisamment examinées." Le médecin et minérale collecteur Friedrich Gabriel Sulzer analysé avec Johann Friedrich Blumenbach la matière minérale de Strontian et l'a nommé strontianite. Il est aussi venu à la conclusion que ce était distincte de la withérite et contenait une nouvelle terre (neue Grunderde). En 1793, Thomas Charles Hope, un professeur de chimie à l'Université de Glasgow a proposé le nom de strontiane. Il a confirmé les travaux antérieurs de Crawford et a raconté: «... Considérant qu'il est une terre particulière Je ai pensé qu'il est nécessaire de lui donner un nom que je ai appelé strontiane, de la place il a été constaté, un mode de calcul à mon avis,. complètement que bon que ne importe quelle qualité il peut posséder, qui est la mode actuelle ". L'élément a finalement été isolé par Sir Humphry Davy en 1808 par l' électrolyse d'un mélange contenant le chlorure de strontium et l'oxyde de mercure, et annoncé par lui dans une conférence à la Royal Society le 30 Juin 1808. En accord avec la nomination des autres terres alcalines, il a changé le nom de strontium.
La première application à grande échelle du strontium était dans la production de sucre de betterave à sucre . Bien que l'hydroxyde de strontium processus de cristallisation en utilisant a été breveté par Augustin-Pierre Dubrunfaut en 1849 l'introduction à grande échelle est venu avec l'amélioration du processus au début des années 1870. L'industrie sucrière allemande a utilisé le processus bien dans le 20ème siècle. Avant la Première Guerre mondiale l'industrie du sucre de betterave utilisé 100 000 à 150 000 tonnes d'hydroxyde de strontium pour ce processus par an. L'hydroxyde de strontium a été recyclé dans le procédé, mais la demande des pertes de substitution pendant la production était suffisamment élevé pour créer une demande importante initier minière de dans la strontianite Münster. L'exploitation des strontianite en Allemagne a pris fin lorsque l'exploitation minière des gisements de célestine dans Gloucestershire commencé. Ces mines fournis plus de la fourniture de strontium du monde de 1884 à 1941. Bien que les dépôts dans la célestine Bassin de Grenade ont été connu pour un certain temps l'exploitation minière à grande échelle n'a pas commencé avant les années 1950.
Au cours de l'atmosphérique armes nucléaires essai il a été observé que le strontium-90 est l'un des produits de fission nucléaire avec un rendement relativement élevé. La ressemblance avec le calcium et le risque que le strontium-90 pourrait se enrichir dans les os fait de la recherche sur le métabolisme du strontium un de sujet important.
Occurrence
Le strontium se produit généralement dans la nature, la 15e plus élément abondant sur Terre, estimée en moyenne à environ 360 parties par million dans la La croûte terrestre et se trouve principalement sous la forme de la sulfate minérale célestine (SrSO 4) et le carbonate strontianite (SrCO 3). Des deux, la célestine se produit beaucoup plus fréquemment dans les dépôts sédimentaires de taille suffisante pour rendre le développement des installations minières attrayant. Parce que le strontium est utilisée le plus souvent sous la forme de carbonate, strontianite serait le plus utile des deux minéraux communs, mais peu de gisements ont été découverts qui sont appropriés pour le développement.
Le contenu de strontium moyenne de l'eau de mer est de 8 mg / l. A une concentration comprise entre 82 et 90 umol / L de concentration du strontium est inférieur considérable de la concentration de calcium qui est normalement comprise entre 9,6 et 11,6 mmol / l.
Production
Selon le British Geological Survey, la Chine était le premier producteur de strontium en 2007, avec plus de deux tiers des parts de monde, suivie par l'Espagne, le Mexique, la Turquie, l'Argentine et l'Iran.
De grandes quantités de l'extrait célestine (SrSO 4) sont convertis en le carbonate par deux procédés. Soit la célestine est directement lixivié avec une solution de carbonate de sodium ou la célestine est calciné avec le charbon pour former du sulfure. Le second processus résulte un matériau de couleur foncée contenant du sulfure essentiellement baryum. Ce soi-disant frêne noir est dissous dans l'eau et filtré. Le carbonate de baryum est précipité de la solution de sulfure de baryum par introduction de dioxyde de carbone. Le sulfate est réduit en sulfure par la réduction carbothermique:
- SrSO 4 + C → SrS + 2 CO 2
Environ 300 000 tonnes sont traitées de cette manière chaque année.
Le métal est produit industriellement par réduction de strontium avec de l'oxyde d'aluminium . Le strontium est distillé à partir du mélange. Le strontium métallique peut en principe être préparé par électrolyse d'une solution de le chlorure de strontium en fondu chlorure de potassium:
- Sr 2+ + 2 e - → Sr
- 2 Cl - → Cl 2 + 2 e -
Isotopes
Strontium a quatre stables, naturelles isotopes : 84 Sr (0,56%), 86 Sr (9,86%), 87 Sr (7,0%) et 88 Sr (82,58%). Seulement 87 Sr est radiogénique; il est produit par la désintégration de la métal alcalin radioactif 87 Rb , qui a une demi-vie de 4,88 × 10 10 ans. Ainsi, il ya deux sources de 87 Sr en toutes matières: d'abord la partie formée dans les étoiles avec les isotopes 84 Sr Sr, 86, 88 et Sr; et le second la partie formée par la désintégration radioactive du 87 Rb. Le rapport de 87 Sr / 86 Sr est le paramètre généralement rapporté dans géologiques enquêtes; ratios minéraux et des roches ont des valeurs allant d'environ 0,7 à plus de 4,0. En raison de strontium a un rayon atomique proche de celui du calcium , il remplace aisément de Ca dans les minéraux .
Seize isotopes instables peuvent apparaître. De plus grande importance sont 90 Sr avec une demi-vie de 28,78 années et 89 Sr avec une demi-vie de 50,5 jours. 90 Sr est un sous-produit de la fission nucléaire trouvé dans retombées nucléaires et présente un problème de santé car il se substitue à calcium dans os, ce qui empêche l'expulsion de l'organisme. Cet isotope est l'un des meilleurs à haute énergie à long vécu les émetteurs bêta connus, et sont utilisées dans SNAP ( Systèmes pour) des dispositifs auxiliaires de puissance nucléaire. Ces dispositifs sont prometteuses pour une utilisation dans engins spatiaux, les stations météorologiques éloignées, bouées de navigation, etc., où une longue durée la source nucléaire électrique légère, de puissance est nécessaire. L' accident nucléaire de Tchernobyl 1986 contaminé une vaste zone avec 90 Sr 90 Sr confinée dans une plaque d'argent concave est également utilisé pour le traitement médical d'une résection ptérygion.
89 Sr est un radio-isotope de courte durée artificiel qui est utilisé dans le traitement de cancer des os. Dans les cas où les patients cancéreux ont osseuse généralisée et douloureuse (métastases secondaires), l'administration de 89 résultats Sr dans la prestation des émissions radioactives ( particules bêta dans ce cas) directement à la zone de problème osseuse (où le chiffre d'affaires de calcium est le plus grand). Le 89 Sr est fabriqué sous forme de sel de chlorure (qui est soluble), et lorsqu'il est dissous dans une solution saline normale peut être injecté par voie intraveineuse. En général, les patients cancéreux sont traités avec une dose de 150 MBq. Les patients doivent prendre des précautions suivantes car leur urine est contaminée par la radioactivité, de sorte qu'ils doivent se asseoir pour uriner et double chasse d'eau. Le particules bêta voyagent environ 3,5 mm dans l'os (énergie 0,583 MeV) et 6,5 mm dans le tissu, donc il n'y a pas d'obligation d'isoler les patients ayant été traités, sauf pour dire qu'ils ne devraient pas avoir une quelconque (en particulier les jeunes enfants) assis sur leurs genoux pour 10-40 jours. La variation dans les résultats de temps entre le moment de compensation variable pour 89 Sr, qui dépend de la fonction rénale et le nombre de métastases osseuses. Avec beaucoup de métastases osseuses, la dose de 89 Sr entier peut être repris dans l'os et ainsi la radioactivité est conservé à la pourriture sur une demi-vie de 50,5 jours. Il faut environ 10 demi-vies ou environ 500 jours pour 99,9% du strontium radioactif à la pourriture. Cependant, se il existe peu de métastases osseuses, la grande proportion de 89 Sr pas repris par de l'os sont filtrés par les reins, de sorte que la demi-vie effective (une combinaison de la demi-vie physique et biologique) sera beaucoup plus court.
Applications

Consommer 75% de la production, l'utilisation principale pour le strontium est en verre pour la couleur la télévision tubes à rayons cathodiques. Il empêche Émission de rayons X. Toutes les parties du tube CRT doivent absorber les rayons-X. Dans le col et l'entonnoir du tube, le verre au plomb est utilisé à cet effet, mais ce type de verre présente un effet de brunissement dû à l'interaction des rayons X avec le verre. Par conséquent, le panneau avant doit utiliser un mélange de verre différent, dans laquelle le strontium et le baryum sont les matériaux de rayons X absorbant. Les valeurs moyennes pour le mélange de verre déterminé pour une étude sur le recyclage en 2005 est de 8,5% l'oxyde de strontium et 10% l'oxyde de baryum. La quantité de strontium utilisé pour la production d'un tube à rayons cathodiques diminue parce que les tubes cathodiques sont remplacés par d'autres procédés de présentation. Cette baisse a une influence significative sur l'extraction et le raffinage de strontium.
Pyrotechnie
le carbonate de strontium ou d'un autre strontium sels sont utilisés dans la fabrication de feux d'artifice, car ils donnent une couleur rouge profond pour le feu d'artifice. Cette application consomme environ 5% de la production mondiale.
Utilisations pour strontium radioactif
89 Sr est l'ingrédient actif dans Metastron (la version générique de Metastron, générique chlorure de strontium Sr-89 Injection, fabriqué par son Bio-Nucleonics Inc.), un radiopharmaceutique utilisé pour la douleur osseuse secondaire à métastatique cancer des os. Le strontium se comporte comme le calcium et est préférentiellement incorporé dans l'os sur les sites de l'augmentation ostéogenèse. Cette localisation se concentre l'irradiation sur la lésion cancéreuse.

90 Sr a été utilisé comme une source d'alimentation pour générateurs thermoélectriques radio-isotopiques (GTR). 90 Sr produit environ 0,93 watts de chaleur par gramme (il est plus faible pour la forme de 90 Sr utilisé dans GTR, qui est le fluorure de strontium). Cependant, 90 Sr a une durée de vie d'environ trois fois plus court et a une densité inférieure à celle 238 Pu, un autre combustible RTG. L'avantage principal de 90 Sr est qu'il est moins cher que Pu 238 et se trouve dans déchets nucléaires. Union soviétique a déployé près de 1000 de ces GTR sur la côte nord comme source d'alimentation pour les phares et les stations de météorologie.
90 Sr est également utilisé dans le cancer thérapie. Son émission bêta et longue demi-vie est idéal pour superficielle la radiothérapie.
Parce que le strontium est très similaire au calcium, il est incorporé dans l'os. Tous les quatre isotopes stables sont incorporés, dans des proportions à peu près semblables, car ils se trouvent dans la nature. Cependant, la répartition réelle des isotopes tend à varier considérablement d'un lieu à un autre. Ainsi, l'analyse de l'os d'un individu peut aider à déterminer la région il vient. Cette approche permet d'identifier les schémas de migration anciennes ainsi que l'origine de l'homme mélangé reste dans les sites d'enfouissement champ de bataille. Strontium, ainsi, aide les scientifiques légistes trop.
87 Sr / 86 Sr sont couramment utilisés pour déterminer les zones de provenance susceptibles de sédiments dans les systèmes naturels, en particulier dans les milieux marins et fluviaux. Dasch (1969) a montré que les sédiments de surface de l'Atlantique affichent 87 Sr / 86 Sr qui pourraient être considérés comme des moyennes en vrac de 87 Sr / 86 Sr de terrains géologiques de masses terrestres adjacentes. Un bon exemple d'un système fluvial-maritime vers laquelle les études de provenance des isotopes Sr ont été utilisés avec succès est le système-méditerranéen du Nil, en raison des différents âges des roches qui constituent la majorité de la bleu et le Nil blanc, bassins versants de la changer la provenance des sédiments d'atteindre le delta du Nil et Méditerranée orientale peut être discerné par des études isotopiques Sr. Ces changements sont climatiquement contrôlés à la fin du Quaternaire.
Plus récemment, 87 Sr / 86 Sr ont également été utilisés pour déterminer la source des matériaux archéologiques antiques, tels que bois et du maïs à Chaco Canyon, Nouveau-Mexique. 87 Sr / 86 Sr dans les dents peut également être utilisé pour suivre les migrations animales ou en médecine légale criminelles.
applications de niche
Le chlorure de strontium est parfois utilisé dans dentifrices pour dents sensibles. Une marque populaire comprend 10% du total hexahydrate de chlorure de strontium en poids.
De petites quantités sont utilisées dans le raffinage du zinc, pour éliminer les petites quantités d'impuretés de plomb.
Tendances de la recherche
Autres applications possibles suivent:
- Titanate de strontium a un niveau extrêmement élevé et un indice de réfraction dispersion optique supérieure à celle du diamant , ce qui est utile dans une variété d'applications de l'optique. Cette qualité a également conduit à son être coupé en pierres précieuses, en particulier en tant que diamant simulant. Cependant, il est très doux et gratte donc il est rarement utilisé facilement.
- Aimants en ferrite.
- Aluminate de strontium est utilisé comme un brillant phosphore avec une longue persistance de la phosphorescence.
- l'oxyde de strontium est parfois utilisé pour améliorer la qualité de certains poterie émaux.
- Le ranélate de strontium est utilisé dans le traitement de l'ostéoporose. Ce est un médicament d'ordonnance dans l'UE, mais pas aux Etats-Unis.
- Strontium niobate de baryum peut être utilisé dans les écrans 3D holographiques extérieur comme un «écran».
Le strontium métallique est utilisé en strontium 90% à 10% -aluminium des alliages d'un composition eutectique pour la modification de l'aluminium-silicium d'alliages de coulée. AJ62, une solution durable, résistant au fluage alliage de magnésium utilisé dans les moteurs de voitures et de motos par BMW, contient 2% en poids de strontium.
Le strontium est utilisé dans des études scientifiques de la libération de neurotransmetteurs dans les neurones. Comme le calcium, le strontium facilite fusion des vésicules synaptiques avec la membrane synaptique. Mais, à la différence de calcium, le strontium asynchrone provoque la fusion des vésicules. Par conséquent, le remplacement de calcium dans un milieu de culture avec de strontium permet aux scientifiques de mesurer les effets d'un événement de fusion unique vésicule, par exemple, la taille de la réponse post-synaptique induite par le contenu du neurotransmetteur d'une seule vésicule.
Le concept important pour le traçage isotopique est que Sr dérivé de tout minéral par des réactions d'altération auront le même 87 Sr / 86 Sr que le minéral. Par conséquent, les différences de 87 Sr / 86 Sr entre les eaux souterraines nécessitent soit (a) des différences dans la minéralogie long de voies d'écoulement contrasté ou (b) des différences dans les quantités relatives de Sr altérés de la même suite de minéraux. Cette dernière situation peut se produire de diverses façons. Premièrement, les différences dans la chimie de l'eau initiale dans une unité de roche homogène auront une incidence sur les taux d'altération relatives des minéraux. Par exemple, des sections de la zone des sols affectés par la concentration par évaporation des eaux de recharge ou par des différences dans pCO 2 peut se attendre à avoir différentes 87 Sr / 86 Sr Deuxièmement, les différences dans les mobilités relatives d'eau à des échelles allant de pores inter-grains à l'échelle du bassin versant peuvent également affecter profondément 87 Sr / 86 Sr (Bullen et al., 1996). Par exemple, la composition chimique et la résultante 87 Sr / 86 Sr dans les eaux immobiles à un joint de grain plagioclase-hornblende contre une limite de quartz-mica seront différentes. En troisième lieu, une différence dans les domaines relatifs "efficaces" de surface des minéraux dans une partie de l'unité de roche également entraîner des variations de la chimie et de la composition isotopique; «Empoisonnement» des surfaces réactives par des revêtements organiques est un exemple de ce genre de processus. Dans un sens fondamental, parce que les eaux peu profondes dans les systèmes ne sont pas en équilibre chimique avec les roches, il est irréaliste de se attendre à ce que les eaux le long des voies d'écoulement au sein même d'une unité constante minéralogie devraient avoir une constante 87 Sr / 86 Sr Au lieu de cela, les eaux se déplaçant le long des voies d'écoulement spécifiques réagissent lentement avec les roches et se approchent progressivement l'équilibre chimique sur de longues périodes,.
Composés

formes de strontium une variété de sels, dont les propriétés sont toujours intermédiaire entre ceux de baryum et de calcium . Les sels ont tendance à être incolore. Le sulfate et le carbonate sont peu solubles, d'où leur présence que les minéraux. La plupart des composés sont dérivés du carbonate ou du sulfure, qui est obtenu à partir de minéraux. Typique pour un dérivé de métal alcalino-terreux, le sulfure d'hydrolyse facilement:
- SrS + 2 H 2 O → Sr (OH) 2 + H 2 S
Des réactions similaires sont utilisés dans la production de composés utiles dans le commerce, y compris le composé de strontium plus utile, le carbonate de strontium.
- SrS + H 2 O + CO 2 → SrCO 3 + H 2 S
nitrate de strontium peuvent également être préparés de cette manière.
Rôle biologique
Acantharea un grand groupe relatif de marine radiolaires protozoaires produisent complexe minéral composé de squelettes sulfate de strontium. Dans les systèmes biologiques calcium est substitué dans une faible mesure par le strontium. Dans le corps humain plupart du strontium absorbé est déposé dans les os. Le rapport du strontium au calcium dans les os humains est compris entre 1: 1000 et 1: 2000 à peu près dans la même plage comme dans le sérum sanguin.
Effet sur le corps humain
Le humaine corps absorbe le strontium comme si ce était le calcium . En raison de la similarité chimique des éléments, les formes stables de strontium pourraient ne pas peser une menace de santé important - en fait, les niveaux trouvés naturellement peuvent en fait être bénéfique (voir ci-dessous) - mais le 90 Sr radioactifs peuvent conduire à diverses troubles et d'os maladies , y compris cancer des os. Le unité de strontium est utilisée pour mesurer la radioactivité absorbée de 90 Sr.
Une récente étude in vitro menée le Collège des sciences dentaires de NY en utilisant le strontium sur ostéoblastes ont montré une amélioration marquée sur les ostéoblastes de renforcement des os.
Le médicament ranélate de strontium, faite en combinant strontium l'acide ranélique, a été retrouvé à l'aide la croissance osseuse, augmenter la densité osseuse et réduire vertébrale, périphérique, et de la hanche fractures. Les femmes recevant le médicament ont montré une augmentation de 12,7% de la densité osseuse. Les femmes recevant un placebo ont présenté une diminution de 1,6%. La moitié de l'augmentation de la densité osseuse (mesurée par densitométrie aux rayons X) est attribuée à la masse atomique de Sr supérieur par rapport au calcium, tandis que l'autre moitié une augmentation réelle de la masse osseuse. Le ranélate de strontium est inscrit comme un médicament de prescription en Europe et de nombreux pays dans le monde entier. Il doit être prescrit par un médecin, doit être délivré par un pharmacien, et nécessite une surveillance médicale stricte.
Il ya une longue histoire de la recherche médicale concernant les avantages de strontium, en commençant dans les années 1950. Des études indiquent une absence d'effets secondaires indésirables. Plusieurs autres sels de strontium tels que le citrate de strontium et le carbonate de strontium sont disponibles aux États-Unis en vertu de la Loi sur la santé suppléments alimentaires et de l'éducation de 1994, fournissant près de la teneur en strontium recommandé, environ 680 milligrammes par jour, des ranélate de strontium. Leur innocuité à long terme et l'efficacité ne ont pas été évalués dans les essais sur les humains médicales à grande échelle. Toutefois, certaines entreprises ne fabriquent des pilules de strontium pour augmenter la santé des os.
