
Cloreto de fosforilo
Sobre este escolas selecção Wikipedia
Os artigos desta seleção Escolas foram organizados por tópico currículo graças a voluntários Crianças SOS. Antes de decidir sobre o patrocínio de uma criança, por que não aprender sobre as diferentes instituições de caridade de patrocínio primeiro ?
| Cloreto de fosforilo | |
|---|---|
 | |
 | |
Cloreto de fosforilo ou | |
Outros nomes Oxicloreto de fósforo | |
| Identificadores | |
| Número CAS | 10025-87-3 |
| Número RTECS | TH4897000 |
| Propriedades | |
| Fórmula molecular | POCl3 |
| Massa molar | 153,33 g / mol |
| Aparência | Claro, líquido incolor, vapores no ar úmido |
| Densidade | 1,645 g / cm 3, líquido |
| Ponto de fusão | 1,25 ° C (274,4 K) |
| Ponto de ebulição | 105,8 ° C (379,0 K) |
| Solubilidade em água | Reage |
| Viscosidade | ? c P a? ° C |
| Estrutura | |
| Forma molecular | tetrahedral |
| Momento de dipolo | 2.54 D |
| Perigos | |
| MSDS | MSDS External |
| Frases R | 14-22-26-29-35-48 / 23 |
| Frases-S | 26-45-7 / 8 |
| Principal Perigos | Altamente corrosivo, lacrimogéneo, tóxico |
| Os compostos relacionados | |
| Os compostos relacionados | Tiofosforilo cloreto Oxibrometo de fósforo |
| Página Suplementar dados | |
| Estrutura e Propriedades | N, ε r, etc. |
| Termodinâmica dados | Comportamento de fase Sólido, líquido, gasoso |
| Os dados espectrais | UV, IV, RMN , MS |
| Excepto quando indicado, os dados são dados para materiais no seu estado normal (a 25 ° C, 100 kPa) | |
| Referências de Infobox | |
Cloreto de fosforilo (chamado geralmente oxicloreto de fósforo) é um líquido incolor com a fórmula P S Cl 3. Ele hidrolisa no ar úmido para ácido fosfórico para libertar vapores de asfixia cloreto de hidrogénio. É fabricado industrialmente em larga escala a partir de tricloreto de fósforo e oxigénio ou pentóxido de fósforo. É utilizado principalmente para fazer ésteres de fosfato tais como fosfato de tricresilo.
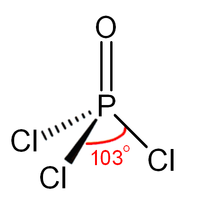
Estrutura
Tal como fosfato, cloreto de fosforilo é em forma tetraédrica. Ele possui três ligações P-CL e um P muito forte = O vínculo duplo, com uma estimativa ligação de energia de dissociação de 533,5 kJ / mol. Com base no comprimento da ligação e electronegatividade, a regra Schomaker-Stevenson sugere que a forma de ligação dupla é muito dominante (em contraste com POF 3). A P = ligação O não se assemelha a ligação π numa como grupo carbonilo em uma cetona. A descrição apropriada da interação PO é uma questão de longa discussão. Livros mais velhos favorecer uma descrição que invoca a participação da d -orbitals em fósforo. Alguns destes orbitais d projecto para o átomo de O, sobreposição com p -orbitals em oxigênio. Textos mais modernos parecem favorecer uma descrição onde o PO π ligação envolve o sigma * componentes das ligações P-Cl. Estas descrições não consideram um papel para orbitais d.
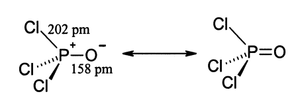
- onde pm = picometros
Propriedades químicas
POCl3 reage com a água e álcoois para se obter o ácido fosfórico ou ésteres de fosfato, respectivamente, por exemplo
- O = PCl 3 + 3 H2O → O = P (OH) 3 + 3 HCl
Se a água é substituído por um álcool , os ésteres de fosfato de trialquilo resultar. Tais reacções são geralmente realizadas na presença de um aceitador, tal como HCl piridina ou uma amina . Se POCl3 é aquecida com um excesso de um fenol ( ArOH) na presença de um Catalisador de ácido de Lewis, tal como cloreto de magnésio de um éster de fosfato de triarilo é formado, por exemplo:
- 3 C 6 H 5 OH + O = PCI3 → O = P (OC 6 H 5) 3 + 3 HCl
POCl3 também pode agir como um Base de Lewis, formando aductos com uma variedade de ácidos de Lewis, tais como tetracloreto de titânio:
- Cl 3 P + -O - + TiCl4 → Cl P + 3-O- - TiCl4
O cloreto de alumínio aducto (POCl3 · AlCl 3) é bastante estável, e assim por POCl 3 pode ser usado para remover AlCl3 completamente a partir de misturas reaccionais no final de um Reacção de Friedel-Crafts. Reage com POCl3 brometo de hidrogénio na presença de AICI3 para produzir POBr3.
Preparação
Cloreto de fosforilo, podem ser preparados pela reacção de tricloreto de fósforo com oxigénio a 20-50 ° C (ar é ineficaz):
Uma sintese alternativa envolve a reacção de pentacloreto de fósforo e pentóxido de fósforo. Uma vez que estes compostos são ambos sólidos, um modo conveniente de realizar a reacção consiste em clorar uma mistura de PCl 3 e P 4 O 10, o qual gera o PCl5 No local. Como o PCl 3 é consumido, o POCl3 torna-se o solvente da reacção.
6 PCl5 + P 4 O 10 → 10 POCl3
Pentacloreto de fósforo também forma POCl3 por reacção com água, mas esta reacção é menos facilmente controlada do que a reacção acima.
Usos
O uso mais importante para o cloreto de fosforilo é no fabrico de ésteres triarylphosphate (como descrito acima ), tal como e fosfato de trifenilo fosfato de tricresilo. Estes ésteres têm sido usados durante muitos anos como retardadores de chama e plastificantes para PVC. Enquanto isso os ésteres de trialquilo, tais como o fosfato de tributilo (feito de forma semelhante a partir de butan-1-ol) são usados como solventes de extracção líquido-líquido em reprocessamento nuclear e em outros lugares.
Na indústria de semicondutores, POCI3 é utilizado como uma fonte de fósforo líquido seguro em processos de difusão. O fósforo actua como um contaminante usado para criar camadas do tipo N sobre uma bolacha de silício.
No laboratório, POCl 3 é amplamente usado como um agente de desidratação, por exemplo a conversão de amidas para nitrilos. Do mesmo modo, certas amidas cíclicas pode ser ciclizado em Diidro derivados de isoquinolina utilizando o Reação Bischler-Napieralski.

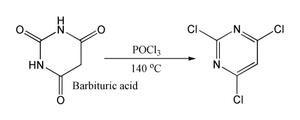
Tais reacções são acreditados para ir através de uma cloreto imidoilo; em certos casos em que é estável, o cloreto de imidoilo é o produto final. Por exemplo piridonas e pirimidonas pode ser convertido em derivados de cloro e piridinas pirimidinas, que são intermediários importantes na indústria farmacêutica. Do mesmo modo ácido barbitúrico é convertida em 2,4,6-tricloropirimidina. por reacção com POCI3, a 140 ° C.
Relacionado com esta química é o uso de POCl3 em acilação do activada anéis aromáticos, através do Reação para produzir Vilsmeier-Haack arilo aldeídos e cetonas . A reacção mais frequentemente utiliza uma formamida tal como DMF ou N-fenil-N -methylformamide, e que produz um sal de imínio, que é facilmente hidrolisado para o aldeído após processamento. Por exemplo antraceno dá 9-anthraldehyde:
