
Química inorgânica
Fundo para as escolas Wikipédia
Esta seleção wikipedia foi escolhido por voluntários que ajudam Crianças SOS da Wikipedia para este Seleção Wikipedia para as escolas. Crianças SOS tem cuidado de crianças na África por 40 anos. Você pode ajudar o seu trabalho na África ?
A: Recursos Diborano ligação incomum
B: Cloreto de césio tem um arquétipo estrutura cristalina
C: Fp 2 é uma complexo organometálico
D: Utilizações de silicone variar desde implantes mamários para Silly Putty
E: Catalisador de Grubbs ganhou o Prêmio Nobel 2005 de seu descobridor
F: As zeólitas encontrar uso extensivo como peneiras moleculares
G: O cobre (II) acetato surpreendido teóricos com a sua diamagnetism
Química inorgânica é o ramo da química em causa com as propriedades eo comportamento de compostos inorgânicos . Este domínio abrange todos os compostos químicos , excepto a miríade de compostos orgânicos (compostos contendo ligações CH), que são os temas de química orgânica . A distinção entre as duas disciplinas está longe de ser absoluta e há muita sobreposição, mais importante na sub-disciplina da química organometálica.
Conceitos chave
A maior parte dos compostos inorgânicos ocorrem como sais , a combinação de catiões e aniões por juntou ligação iónica. Exemplos de catiões são o sódio Na +, e magnésio Mg 2+ e exemplos de aniões são O óxido de 2- e cloreto de Cl -. Como sais têm carga neutra, estes iões formar compostos, tais como óxido de sódio Na2O ou cloreto de magnésio MgCl2. Os iões são descritas pelo seu estado de oxidação e a sua facilidade de formação pode ser inferida a partir da potencial de ionização (por catiões) ou a partir da afinidade eletrônica (ânions) dos elementos pai.
Classes importantes de compostos inorgânicos são o os óxidos, os carbonatos , os sulfatos e o halogenetos. Muitos compostos inorgânicos são caracterizadas por altos pontos de fusão . Os sais inorgânicos tipicamente são pobres condutores no estado sólido. Outra característica importante é a sua solubilidade em água, por exemplo (ver: gráfico de solubilidade), e facilidade de cristalização. Sempre que alguns sais (por exemplo NaCl ) são muito solúveis em água, os outros (por exemplo, SiO 2 ) não são.
A mais simples de reacção inorgânico é deslocamento dobro quando em mistura de dois sais os íons são trocados sem uma mudança no estado de oxidação. Em reacções redox, um reagente, o oxidante, reduz o seu estado de oxidação e um outro reagente, o redutor, tem aumentado o seu estado de oxidação. O resultado líquido é uma troca de elétrons . Troca de elétrons pode ocorrer indiretamente, bem como, por exemplo, em pilhas, um conceito-chave na eletroquímica.
Quando um reagente contém átomos de hidrogênio, uma reação pode ocorrer através da troca de prótons em química ácido-base . Em uma definição mais geral, um ácido pode ser qualquer espécie químicos capazes de se ligarem aos pares de electrões é denominado Ácido de Lewis; inversamente, qualquer molécula que tende a doar um par de electrões é referida como um Base de Lewis. Como um refinamento das interacções ácido-base, o HSAB teoria leva em conta polarizabilidade e tamanho de íons.
Os compostos inorgânicos são encontradas na natureza como minerais . O solo pode conter sulfeto de ferro como pirita ou sulfato de cálcio como gesso . Compostos inorgânicos também são encontrados como multitarefa biomoléculas: electrólitos (como cloreto de sódio ), no armazenamento de energia ( ATP ) ou em construção (a polifosfato na espinha dorsal do ADN ).
A primeira importante composto inorgânico feita pelo homem era nitrito de amónio para a fertilização do solo através da Processo Haber. Os compostos inorgânicos são sintetizados para serem utilizados como catalisadores , tais como vanádio (V) e óxido de titânio (III), cloreto, ou como reagentes em química orgânica , tais como hidreto de alumínio e lítio .
Subdivisões de química inorgânica são química organometálica, química cluster e bioinorgânica química. Estes campos são áreas ativas de pesquisa em química inorgânica, visando em direção a novas catalisadores , supercondutores e terapias .
Química inorgânica industrial
Química inorgânica é uma área altamente prático da ciência. Tradicionalmente, a escala da economia de uma nação pode ser avaliado por sua produtividade de ácido sulfúrico. Os 20 produtos químicos inorgânicos fabricados no Canadá, China, Europa, Japão e os EUA (dados de 2005): sulfato de alumínio, amoníaco , nitrato de amónio, sulfato de amónio, negro de carbono, cloro , ácido clorídrico , hidrogénio , peróxido de hidrogénio , ácido nítrico , azoto , oxigénio , ácido fosfórico , carbonato de sódio, de clorato de sódio, hidróxido de sódio , silicato de sódio, sulfato de sódio , ácido sulfúrico , e dióxido de titânio,
Química inorgânica descritiva
Química inorgânica descritiva incide sobre a classificação dos compostos com base em suas propriedades. Parcialmente a classificação centra-se na posição na tabela periódica dos elementos mais pesados (o elemento com o mais elevado peso atómico) no composto, em parte, pelo agrupamento de compostos pelas suas semelhanças estruturais. Ao estudar compostos inorgânicos, um frequentemente encontra partes das diferentes classes de química inorgânica (um composto organometálico é caracterizado pela sua química de coordenação, e podem mostrar propriedades de estado sólido interessantes).
Diferentes classificações são:
Compostos de coordenação
Compostos de coordenação clássicos apresentam metais ligados a " pares de electrões solitários "que residem sobre os principais grupos de átomos de ligandos, tais como H2O, NH3, Cl -, e CN -. Em compostos de coordenação modernos quase todos os compostos orgânicos e inorgânicos podem ser utilizados como ligandos. O "metal" é geralmente um metal dos grupos 3-13, assim como os trans - lantanídeos e trans - actinídeos , mas a partir de um determinado ponto de vista, todos os compostos químicos pode ser descrito na forma de complexos de coordenação.
A estereoquímica de complexos de coordenação pode ser muito rico, como sugerido por separação de Werner de dois de enantiómeros [Co ((OH) 2 Co (NH3) 4) 3] 6+, uma manifestação precoce quiralidade que não é inerente aos compostos orgânicos. Um tema tópica dentro desta especialização é a química supramolecular coordenação.
- Exemplos: [Co ( EDTA)] -, [Co (NH3) 6] 3+, TiCl4 ( THF) 2.
Compostos do grupo principal

Estas espécies apresentam elementos de grupos 1, 2 e 13-18 (excluindo hidrogénio) da tabela periódica. Devido à sua reactividade com frequência semelhante, os elementos do grupo 3 ( Sc , Y , e La ) e Grupo 12 ( Zn , Cd e Hg ) também são geralmente incluídos.
Compostos de grupos principais são conhecidos desde os primórdios da química, por exemplo elementar de enxofre e do branco destilável fósforo . Experimentos em oxigênio, O 2 , por Lavoisier e Priestley não só identificou um importante gás diatômico, mas abriu o caminho para descrever compostos e reações de acordo com razões estequiométricas. A descoberta de uma síntese prática de amoníaco utilizando catalisadores de ferro pela Carl Bosch e Fritz Haber no início de 1900 impactou profundamente a humanidade, demonstrando a importância da síntese química inorgânica. Compostos típicos são grupos principais SiO2, SnCl4, e N 2 O. Muitos compostos de grupos principais também podem ser classificados como "organometálica", pois eles contêm grupos orgânicos, por exemplo B ( CH 3) 3). Compostos do grupo principal também ocorrem na natureza, por exemplo, fosfato no DNA e, portanto, podem ser classificados como bioinorgânica. Por outro lado, os compostos orgânicos que faltam ligantes (muitos) de hidrogênio pode ser classificado como "inorgânico", como os fulerenos, buckytubes e óxidos de carbono binários.
- Exemplos: tetrasulfur tetranitride S 4 N 4, diborano B 2 H 6, silicones, buckminsterfullerene C 60.
Compostos de metais de transição
Os compostos que contêm metais do grupo 4 a 11 são considerados compostos de metais de transição. Os compostos com um metal do grupo 3, ou 12 são, por vezes, também incorporadas neste grupo, mas também muitas vezes classificados como compostos do grupo principal.
Compostos de metais de transição mostram uma rica química de coordenação, variando de tetrahedral para o titânio (por exemplo, TiCl 4) ao quadrado planar para alguns complexos de níquel para Octahedral para complexos de coordenação de cobalto. Uma gama de metais de transição podem ser encontrados em compostos biologicamente importantes, tais como o ferro na hemoglobina.
- Exemplos: pentacarbonil ferro, tetracloreto de titânio, cisplatina
Os compostos organometálicos
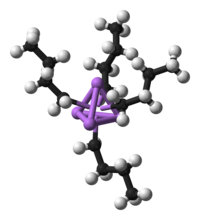
Geralmente, os compostos organometálicos são considerados para conter o grupo MCH. O metal (M) em destas espécies pode ser um elemento do grupo principal ou de um metal de transição. Operacionalmente, a definição de um composto organometálico é mais relaxado para incluir também altamente Complexos lipofilicos tais como carbonyls metal e até mesmo metal alcóxidos.
Os compostos organometálicos são consideradas principalmente uma categoria especial porque ligantes orgânicos são muitas vezes sensíveis à hidrólise ou oxidação, necessitando que química organometálica emprega métodos preparativos mais especializados do que era tradicional em Werner tipo complexos. Metodologia sintética, especialmente a capacidade para manipular os complexos em solventes de baixo poder de coordenação, permitiu a exploração de ligandos muito fraca coordenação tais como hidrocarbonetos, H 2 e N 2. Porque os ligantes são petroquímicos, em certo sentido, a área de química organometálica tem beneficiado muito com a sua relevância para a indústria.
- Exemplos: Ciclopentadienilferro dicarbonilo dímero (C 5 H 5) Fe (CO) 2 CH 3, Ferroceno Fe (C 5 H 5) 2, Molibdênio hexacarbonilo Mo (CO) 6, Diborano B 2 H 6, Adicionou-se tetraquis (trifenilfosfina) paládio (0) Pd [P (C 6 H 5) 3] 4
Compostos Cluster
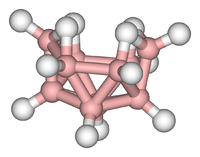
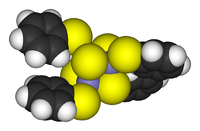
Os agregados podem ser encontradas em todas as classes de compostos químicos . De acordo com a definição geralmente aceite, um cluster consiste pelo menos de um conjunto triangular de átomos que estão directamente ligados um ao outro. Mas metal-metal ligado complexos dimetallic são altamente relevantes para a área. Clusters ocorrer em sistemas inorgânicos "puros", química organometálica, principal grupo de química e química bioinorgânica. A distinção entre muito grandes aglomerados e sólidos a granel é cada vez mais ténue. Essa interface é a base química da nanociência ou nanotecnologia e surgem especificamente a partir do estudo de efeitos quânticos de tamanho em clusters de seleneto de cádmio. Assim, grandes aglomerados pode ser descrita como uma série de átomos ligados intermédios em caracter entre a molécula e um sólido.
- Exemplos: Fe 3 (CO) 12, B 10 H 14, [Mo 6 Cl 14] 2-, 4FE-4S
Compostos bioinorgânicos
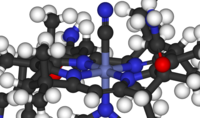
Veja também Química Bioorganometallic
Estes compostos ocorrem (por definição) na natureza, mas o subcampo inclui espécies, tais como antropogénicas poluentes e medicamentos, por exemplo, Cisplatina. O campo inclui muitos compostos, por exemplo, os fosfatos no DNA, mas também os complexos de metal contendo ligandos que variam de macromoléculas biológicas, normalmente péptidos, para espécies mal definidas tais como ácidos orgânicos, e água (por exemplo, coordenada para gadolínio complexos empregados para RM).
- Exemplos: hemoglobina, metilmercúrio, carboxypeptidase
Compostos de estado sólido
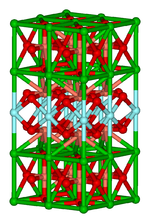
Esta área importante incide sobre estrutura de ligação, e as propriedades físicas dos materiais. Na prática, a química inorgânica de estado sólido utiliza técnicas tais como a cristalografia para obter uma compreensão das propriedades que resultam de interacções entre as subunidades colectivos do sólido. Incluídos em química do estado sólido são os metais e os seus ou derivados ligas intermetálicas. Campos relacionados são física da matéria condensada , mineralogia, e ciência dos materiais .
- : Exemplos chips de silício , zeólitos, YBa 2 Cu 3 O 7
Química inorgânica teórica
Uma perspectiva alternativa sobre a área de química inorgânica começa com a Modelo de Bohr do átomo e, usando as ferramentas e modelos de química teórica e química computacional , expande-se para a ligação em moléculas mais complexas e simples, em seguida. Descrições da mecânica quântica precisos para as espécies multielectron, a província de química inorgânica, é difícil. Este desafio tem gerado muitas abordagens semi-quantitativa ou semi-empíricos, incluindo teoria orbital molecular e teoria do campo ligante, Em paralelo com estas descrições teóricas, metodologias aproximadas são utilizadas, incluindo teoria do funcional da densidade.
As excepções a teorias, qualitativos e quantitativos, são extremamente importantes no desenvolvimento do campo. Por exemplo, II Cu 2 (OAc) 4 (H2O) 2 é quase diamagnético abaixo da temperatura ambiente enquanto que Cristal Campo teoria prevê que a molécula teria dois electrões desemparelhados. O desacordo entre a teoria qualitativa (paramagnética) e observação (diamagnetic) levou ao desenvolvimento de modelos de "acoplamento magnético." Estes modelos melhorados levou ao desenvolvimento de novos materiais magnéticos e novas tecnologias.
Teorias qualitativos
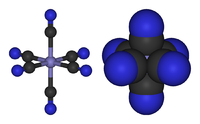
Química inorgânica tem beneficiado muito com as teorias qualitativas. Tais teorias são mais fáceis de aprender como eles exigem pouco de fundo na teoria quântica. Dentro de compostos do grupo principal, Teoria VSEPR poderosamente prevê, ou pelo menos racionaliza, o estruturas de compostos do grupo principal, como uma explicação para NH 3 é piramidal enquanto ClF 3 é em forma de T. Para os metais de transição, teoria do campo de cristal permite compreender o magnetismo de muitos complexos simples, como por [Fe III (CN) 6] 3- tem apenas um electrão não emparelhado, enquanto que [Fe III (H2O) 6] 3+ tem cinco. A abordagem qualitativa particularmente poderoso para avaliar a estrutura e reactividade começa com moléculas classificando de acordo com contagem eletrônica, com foco sobre o número de electrões de valência, geralmente no átomo central numa molécula.
Teoria Molecular Simetria Grupo

A construção central em química inorgânica é a teoria da simetria molecular. Mathematical teoria do grupo fornece a linguagem para descrever as formas das moléculas de acordo com a sua " ponto grupo de simetria ". A teoria do grupo também permite factoring e simplificação dos cálculos teóricos.
Características espectroscópicas são analisados e descrita no que diz respeito às propriedades de simetria da, inter alia, de vibração ou estados electrónicos. O conhecimento das propriedades de simetria do solo e estados excitados permite prever os números e as intensidades de absorção no espectro de vibração e electrónicos. A aplicação clássica da teoria do grupo é a previsão do número de vibrações CO em complexos de metal carbonilo substituído. As aplicações mais comuns de simetria para espectroscopia envolvem espectros vibracionais e electrónicos.
Como uma ferramenta instrucional, Teoria Grupo destaca semelhanças e diferenças na ligação de espécies de outra forma díspares, tais como WF 6 e Mo (CO) 6 ou CO 2 e NO2.
Vias reaccionais
A teoria de reações químicas é mais desafiador do que a teoria para uma molécula estática. Teoria Marcus fornece uma ligação forte entre vínculo, mecanismo, e reactividade. Os pontos fortes relativos dos títulos ligando-metal, que pode ser calculada teoricamente, antecipa as vias cineticamente acessíveis.
Termodinâmica e química inorgânica
Uma abordagem quantitativa alternativa à química inorgânica se concentra em energias de reações. Esta abordagem é altamente tradicional e empírica, mas também é útil. Conceitos gerais que estão redigidos em termos termodinâmicos incluem potencial redox, acidez , fase alterações. Um conceito clássico em termodinâmica inorgânicos é o Ciclo de Born-Haber, que é usado para avaliar as energias de processos elementares, tais como afinidade eletrônica, alguns dos quais não podem ser observados diretamente.
Química inorgânica mecanicista
Um aspecto importante e cada vez mais popular de química inorgânica concentra-se em vias de reação. Os mecanismos de reacções são discutidas de forma diferente para diferentes classes de compostos.
Principais elementos do grupo e lantanídeos
Os mecanismos de compostos do grupo de grupos principais 13-18 são geralmente discutido no contexto da química orgânica (compostos orgânicos são compostos de grupo principal, depois de tudo). Elementos mais pesados do que C, N, O e F, muitas vezes formar compostos com mais elétrons do que o previsto pela regra do octeto, como explicado no artigo sobre hipervalentes moléculas. Os mecanismos das suas reacções diferem a partir de compostos orgânicos, por esta razão. Os elementos mais leves do que carbono ( B , Be , Li ), bem como Al e Mg frequentemente formar estruturas deficientes em electrões que são electronicamente semelhante a carbocátions. Tais espécies elétron-deficiente tendem ro reagir através de vias associativas. A química dos lantanídeos espelha muitos aspectos da química visto para o alumínio.
Complexos de metais de transição
Os mecanismos para as reacções de metais de transição são discutidos de forma diferente a partir de compostos de grupo principal. O papel importante dos orbitais d em ligação influencia fortemente as vias e taxas de substituição do ligando e dissociação. Estes temas são abordados em artigos sobre e química de coordenação ligando. Ambos caminhos associativos e dissociativos são observados.
Um aspecto fundamental da mecânica química metal de transição é a labilidade cinética do complexo ilustrado pela troca de água livre e ligado nos complexos prototípicos [M (H 2 O) 6] n +:
- [M (H2O) 6] n + + 6 H2O * → [M (H 2 O *) 6] n + + 6 H2O
- onde H 2 O * indica isotopicamente enriquecido água, por exemplo, H 2 O 17
As taxas de câmbio da água varia de 20 ordens de magnitude em toda a tabela periódica, com complexos de lantanídeos em uma espécie extremas e Ir (III), sendo o mais lento.
Reações redox
Reações redox são predominantes para os elementos de transição. Duas classes de reação redox são consideradas: as reações de transferência de átomo, como a adição oxidativa / eliminação redutiva, e de transferência de elétrons. A reacção redox é essencial "auto-troca", que envolve a degenerada reacção entre um oxidante e um agente redutor. Por exemplo, permanganato de seu parente e um elétron reduzida troca manganato um elétron:
- [MnO 4] - + [Mn * O 4] 2- → [MnO 4] + 2- [Mn * O 4] -
Reacções no ligantes
Ligandos coordenados exibir reactividade distinta dos ligandos livres. Por exemplo, a acidez dos ligandos de amoníaco em [Co (NH3) 6] 3+ é elevada em relação ao NH3 em si. Alkenes ligados a cátions metálicos são reativos para nucleophiles enquanto alkenes normalmente não são. A área grande e industrialmente importante de catálise depende da capacidade de metais para modificar a reactividade de ligandos orgânicos. Catálise homogénea ocorre em solução e catálise heterogénea ocorre quando gasosos ou dissolvidos substratos interagem com superfícies de sólidos. Tradicionalmente catálise homogênea é considerada parte da química organometálica e catálise heterogénea é discutido no contexto de ciência de superfície, um subcampo da química do estado sólido. Mas os princípios básicos químicos inorgânicos são os mesmos. Os metais de transição, quase exclusivamente, reagir com moléculas pequenas, tais como CO, H2, O2, e C 2 H 4. O significado destas matérias-primas industriais conduz a área activa de catálise.
Caracterização dos compostos inorgânicos
Por causa da grande variedade de elementos e os correspondentemente diversas propriedades dos derivados resultantes, química inorgânica está intimamente associada com muitos métodos de análise. Métodos mais antigos tendem a examinar as propriedades a granel, tais como a condutividade eléctrica das soluções, pontos de fusão , solubilidade , e acidez . Com o advento da teoria quântica ea expansão correspondente de aparelhos electrónicos, novos instrumentos foram introduzidos para sondar as propriedades eletrônicas de moléculas inorgânicas e sólidos. Muitas vezes, essas medidas fornecem insights relevantes para os modelos teóricos. Por exemplo, medições no espectro de fotoelétrons de metano demonstrou que descreve a ligação por dois centros a, títulos de dois elétrons previsto entre o carbono e hidrogênio utilizando Ligação de valência não é apropriada para descrever processos de ionização de um modo simples. Tais idéias levaram à popularização da teoria orbital molecular como orbitais totalmente deslocalizados são uma simples descrição mais adequada de remoção de elétrons e de excitação de elétrons.
Técnicas comumente encontradas são:
- A cristalografia de raios-X: Esta técnica permite a determinação de 3D estruturas moleculares.
- Várias formas de espectroscopia
- Espectroscopia de ultravioleta-visível: Historicamente, esta tem sido uma ferramenta importante, uma vez que muitos compostos inorgânicos são fortemente coloridas
- Espectroscopia de RMN : além 1 H e 13 C muitas outras "boas" núcleos RMN (por exemplo, 11 B , 19 F , 31 P , e 195 Pt ) dá informações importantes sobre a estrutura e propriedades do composto. Além disso, o RMN de espécies paramagnéticas pode resultar na informação estrutural importante. RMN de protão também é importante porque o núcleo de hidrogénio luz não é facilmente detectado por cristalografia de raios-X.
- Espectroscopia de infravermelho: Principalmente para absorções de ligantes carbonila
- Ressonância dupla Electron-nuclear (ENDOR) espectroscopia
- Espectroscopia Mössbauer
- Electron-spin ressonância: ESR (ou EPR) permite a medição do ambiente de centros metálicos paramagnéticos.
- Eletroquímica: A voltametria cíclica e técnicas relacionadas sondar as características de compostos redox.
Química inorgânica sintética
Embora algumas espécies inorgânicas podem ser obtidos na forma pura a partir da natureza, a maioria são sintetizados em fábricas de produtos químicos e, no laboratório.
Métodos sintéticos inorgânicos podem ser classificados de acordo com a volatilidade aproximadamente ou a solubilidade dos reagentes componentes. Compostos inorgânicos solúveis são preparados utilizando métodos de síntese orgânica. Para os compostos contendo metais que são reactivos com ar, Linha Schlenk e técnicas de caixa de luva são seguidas. Compostos voláteis e os gases são manipulados em "colectores de vácuo", constituídas por vidro tubagem interligadas através de válvulas, a totalidade dos quais pode ser evacuado a 0,001 mm de Hg ou menos. Os compostos são condensados utilizando azoto líquido (pb 78K) ou outra criogênios. Os sólidos são tipicamente preparados utilizando fornos tubulares, os reagentes e os produtos a serem selados em embalagens, muitas vezes feitas de sílica fundida (SiO 2 amorfa), mas, por vezes, materiais mais especializados, tais como tubos de Ta soldadas ou Pt "barcos". Produtos e reagentes são transportados entre zonas de temperatura para conduzir reacções.
Links
Links para on-line Química Inorgânica Revistas
| |||||||||||||||||
