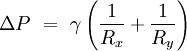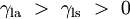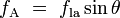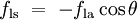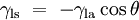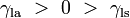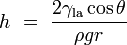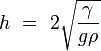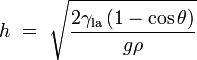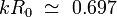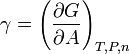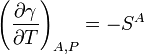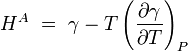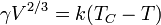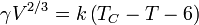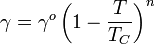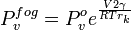Tensão superficial
Informações de fundo
Esta seleção Escolas foi originalmente escolhido pelo SOS Children para as escolas no mundo em desenvolvimento sem acesso à internet. Ele está disponível como um download intranet. Crianças SOS tem cuidado de crianças na África por 40 anos. Você pode ajudar o seu trabalho na África ?
| Mecânica do contínuo |
|---|
 |
Leis
|
Mecânica dos sólidos
|
|
Reologia
|
A tensão superficial é uma propriedade da superfície de um líquido , que faz com que ele se comporte como uma folha elástica. Ela permite que os insectos , tais como o strider água (lagoa skater, Reino Unido ), de andar sobre a água . Ele permite que pequenos objectos, mesmo os de metais, tais como agulhas, lâminas de barbear, ou fragmentos de folha, para flutuar na superfície da água, e é a causa de acção capilar.
O comportamento físico e químico de líquidos não pode ser compreendida sem levar em consideração a tensão superficial. Ele regula a forma que as pequenas massas de líquido podem assumir e o grau de contacto de um líquido pode fazer com uma outra substância.
Aplicando a física newtoniana às forças que surgem devido à tensão superficial é capaz de predizer muitos comportamentos liquidez, que são tão comuns que a maioria das pessoas levá-los para concedido. Aplicando termodinâmica para essas mesmas forças prevê ainda outros comportamentos líquidos mais sutis.
Causa

A tensão superficial é causada pela atracção entre as moléculas do líquido por várias forças intermoleculares. Na maior parte do líquido de cada molécula é puxado igual em todas as direcções por vizinho moléculas de líquido, resultando numa força líquida igual a zero. Na superfície do líquido, as moléculas são puxados para dentro por outras moléculas mais profundas dentro do líquido e não são atraídos tão intensamente pelas moléculas do meio vizinho (seja vácuo, ar ou de outro líquido). Por conseguinte, todas as moléculas na superfície estão sujeitos a uma força para dentro de atracção molecular, que só pode ser equilibrado pela resistência do líquido à compressão. Este puxar para dentro tende a diminuir a área da superfície, e a este respeito, uma superfície do líquido, se assemelha a uma membrana elástica esticada. Assim, o próprio líquido comprime em conjunto até que tem a área de superfície localmente mais baixo possível.
Outra maneira de ver-se que uma molécula em contacto com um vizinho está num estado de energia mais baixo do que se ela não estivesse em contacto com um vizinho. As moléculas de interiores todos têm como muitos vizinhos como eles podem, eventualmente, ter. Mas as moléculas de fronteira têm menos vizinhos do que moléculas de interiores e são, portanto, em um estado mais elevado de energia. Para o líquido para minimizar o seu estado de energia, deve minimizar o número de moléculas de contorno e deve, portanto, minimizar a sua área superficial.
Como resultado da minimização de área de superfície, uma superfície irá assumir a forma mais suave que pode (prova matemática que as formas "suaves" minimizar a área de superfície depende de utilização do Euler-Lagrange Equação). Uma vez que qualquer curvatura nos resultados da forma da superfície em área maior, uma energia superior também irá resultar. Consequentemente, a superfície vai empurrar de volta contra qualquer curvatura da mesma forma que uma bola empurrou ladeira vai empurrar de volta para minimizar sua energia potencial gravitacional.
Efeitos na vida cotidiana
 |  Dropping água de uma torneira |
Alguns exemplos dos efeitos da tensão superficial visto com água comum:
- Perolização de água da chuva sobre a superfície de um automóvel encerado. Água adere fracamente a cera e fortemente para si, de modo clusters de água em gotas. Tensão superficial lhes confere a sua forma quase esférica, porque uma esfera tem a menor superfície possível à relação do volume.
- Formação de gotas ocorre quando uma massa de líquido é esticada. A animação mostra aderente água à torneira ganhando massa até ser esticada para um ponto em que a tensão de superfície não ligam-se que para a torneira pode. Em seguida, separa e tensão de superfície constitui a gota a uma esfera. Se um fluxo de água estavam correndo da torneira, o fluxo iria quebrar-se em gotas durante a sua queda. Gravidade se estende a corrente, então a tensão superficial aperta-lo em esferas.
- Flutuação de objetos mais densos que a água ocorre quando o objeto é nonwettable e seu peso é pequeno o suficiente para ser carregado pelas forças decorrentes da tensão superficial.
- A separação de óleo e água é causada por uma tensão de superfície entre líquidos diferentes. Este tipo de tensão superficial atende pelo nome de "tensão de interface", mas seus física são as mesmas.
- Lágrimas de vinho é a formação de gotas e regatos no lado de um vidro contendo uma bebida alcoólica. Sua causa é uma complexa interação entre as diferentes tensões superficiais de água e etanol .
A tensão superficial é visível em outros fenômenos comuns, especialmente quando certas substâncias, surfactantes, são usados para diminuir:
- Bolhas de sabão têm grandes áreas de superfície com muito pouco volume. Bolhas na água pura são instáveis. A utilização de tensioactivos, embora, indroduce um efeito de estabilização a bolha (ver Efeito de Marangoni). Note-se que os tensioactivos realmente reduzir a tensão superficial da água por um factor de três ou mais.
- As emulsões são um tipo de solução na qual a tensão da superfície desempenha um papel. Fragmentos minúsculos de óleo suspensas em água pura vai reunir-se espontaneamente em massas muito maiores. Mas a presença de um tensioactivo permite obter uma diminuição da tensão superficial, o que permite que a estabilidade de gotículas minúsculas de óleo na massa de água (ou vice-versa).
Física básica
Duas definições
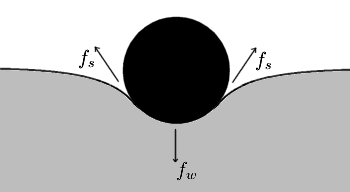
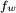 , Comprime a superfície, e é equilibrada por forças de tensão superficial em qualquer um dos lados,
, Comprime a superfície, e é equilibrada por forças de tensão superficial em qualquer um dos lados, 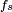 , Que são cada paralelo à superfície da água nos pontos onde entra em contato com a agulha. Note-se que os componentes horizontais das duas
, Que são cada paralelo à superfície da água nos pontos onde entra em contato com a agulha. Note-se que os componentes horizontais das duas 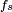 setas apontam em sentidos opostos, de modo que se anulam mutuamente, mas as componentes verticais apontar na mesma direcção e, por conseguinte, adiciona-se a equilibrar
setas apontam em sentidos opostos, de modo que se anulam mutuamente, mas as componentes verticais apontar na mesma direcção e, por conseguinte, adiciona-se a equilibrar 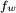 .
. A tensão superficial, representado pelo símbolo σ, γ ou T, é definido como a força ao longo de uma linha de unidade de comprimento, em que a força é paralela à superfície, mas perpendicularmente à linha. Uma maneira de imaginar isso é imaginar um filme de sabão plana delimitada de um lado por um fio esticado de comprimento, L. A discussão será puxado para o interior do filme com uma força igual a 2γL (o factor de 2 é porque a película de sabão tem dois lados, portanto, duas superfícies). A tensão superficial é medida, por conseguinte, em forças por unidade de comprimento. Sua Unidade SI é newton por metro mas o unidade cgs de dines por cm é mais utilizada.
Uma definição equivalente, que seja útil em termodinâmica , é trabalho feito por unidade de área. Como tal, a fim de aumentar a área de superfície de uma massa de líquido, por uma quantidade, Aa, uma quantidade de trabalho, γδA, é necessária. Este trabalho está armazenada como energia potencial. Por conseguinte a tensão superficial pode também ser medido em SI em joules por metro 2 e na Sistema CGS como ergs por cm 2. Uma vez que os sistemas mecânicos tentar encontrar um estado de energia potencial mínima, uma gotícula livre de líquido assume naturalmente uma forma esférica, que tem a área de superfície mínima para um dado volume.
A equivalência de medida de energia por unidade de área para forçar por unidade de comprimento pode ser comprovada por análise dimensional.
Striders da água

A fotografia mostra striders água em pé na superfície de um lago. É claramente visível que os seus pés causar depressões na superfície da água. E é intuitivamente óbvio que a superfície com reentrâncias tem mais área de superfície do que uma superfície plana. Se a tensão superficial tende a minimizar a área de superfície, como é que os striders de água estão a aumentar a área de superfície?
Lembre-se que o que a natureza realmente se esforça para minimizar é a energia potencial. Ao aumentar a área de superfície da água, as striders da água ter aumentado a energia potencial da referida superfície. Mas note também que o centro de massa dos striders água é menor do que seria se eles estavam de pé sobre uma superfície plana. Assim, a sua energia potencial é diminuída. Na verdade, quando você combinar os dois efeitos, a energia potencial líquida é minimizado. Se os striders água deprimido a superfície mais, o aumento da energia de superfície seria mais do que cancelar a diminuição da energia de redução centro de massa dos insetos. Se eles deprimido a superfície menos, seu maior centro de massa seria mais do que cancelar a redução na energia de superfície.
A fotografia das striders da água também ilustra a noção da tensão superficial ser como tendo uma película elástica sobre a superfície do líquido. Nos depressões superficiais aos seus pés é fácil de ver que a reacção da referida película elástica imaginada é exactamente contrariar o peso dos insectos.
Curvatura e pressão à superfície
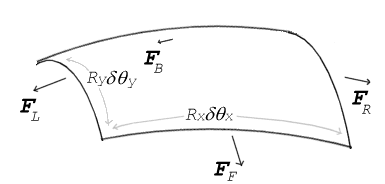
Se nenhuma força actua normal a uma superfície tensionada, a superfície deve permanecer simples. Mas, se a pressão de um lado da superfície igual à pressão no outro lado, a diferença de pressão da área de superfície vezes resulta numa força normal. Para que as forças de tensão superficial para cancelar a força devida à pressão, a superfície deve ser curvada. O diagrama mostra como curvatura da superfície de um pequeno pedaço de superfície conduz a um componente líquido das forças de tensão superficial que actuam normal ao centro do penso. Quando todas as forças são equilibradas, a equação resultante é conhecida como a Equação Laplace-Young:
onde:
- Δ P é a diferença de pressão.
- γ é a tensão superficial.
- R x e R y são raios de curvatura de cada um dos eixos que são paralelos à superfície.
As soluções para esta equação determinar a forma de gotas de água, poças, meniscos, bolhas de sabão, e todas as outras formas determinadas pela tensão superficial (tal como a forma das impressões que os pés de um Água Strider fazer na superfície de um lago).
A tabela abaixo mostra como a pressão interna de uma gota de água aumenta com a diminuição do raio. Para não muito pequenas gotas o efeito é subtil, mas a diferença de pressão se torna grande, quando os tamanhos de gota aproximar do tamanho molecular.
| Δ P de gotas de água de diferentes raios no STP | ||||
|---|---|---|---|---|
| Raio da gota | 1 mm | 0,1 milímetros | 1 pm | 10 nm |
| Δ P ( atm) | 0,0014 | 0,0144 | 1.436 | 143,6 |
Superfície do líquido como um computador

Para determinar a forma da de superfície mínima delimitada por alguns em forma de moldura arbitrária utilizando meios estritamente matemática pode ser uma tarefa assustadora. No entanto, por formar a armação de arame e mergulhando-o em sabão-solução, uma superfície de aproximadamente mínima (exatamente na ausência de gravidade) aparece no filme-sabão resultando em poucos segundos. Sem um único cálculo, a película de sabão-chega a uma solução de uma equação de minimização complexo por si só.
A razão para isto é que a diferença de pressão através de uma interface de fluido é proporcional à curvatura significa, como visto na Lei de Laplace. Para um filme de sabão aberta, a diferença de pressão é zero, portanto, a curvatura média é zero, e as superfícies mínimas têm a propriedade de curvatura zero significativo.
Ângulos de contacto
Uma vez que nenhum líquido pode existir em um vácuo perfeito, a superfície de qualquer líquido é uma interface entre o líquido e qualquer outra forma. A superfície de topo de um tanque, por exemplo, uma interface entre a água do tanque e o ar. A tensão superficial, então, não é uma propriedade do líquido por si só, mas uma propriedade de interface do líquido com uma outra forma. Se é um líquido num recipiente, em seguida, para além da interface líquido / ar na sua superfície superior, há também uma interface entre o líquido e as paredes do recipiente. A tensão superficial entre o líquido e o ar é geralmente diferente (superior) a sua tensão de superfície com as paredes de um recipiente. E onde as duas superfícies se encontram, sua geometria deve ser tal que o equilíbrio de todas as forças.
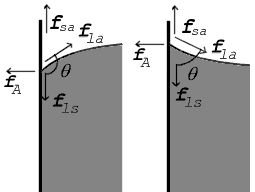 |
Quando as duas superfícies se encontram, eles formam um ângulo de contato,  , Que é o ângulo da tangente da superfície faz com a superfície sólida. O diagrama à direita mostra dois exemplos. O exemplo da esquerda é onde a tensão de superfície sólido-líquido,
, Que é o ângulo da tangente da superfície faz com a superfície sólida. O diagrama à direita mostra dois exemplos. O exemplo da esquerda é onde a tensão de superfície sólido-líquido, 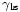 , É menor do que a tensão superficial do líquido-ar,
, É menor do que a tensão superficial do líquido-ar, 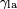 , Mas no entanto é positiva, que é
, Mas no entanto é positiva, que é
No diagrama, tanto as forças verticais e horizontais deve cancelar exatamente no ponto de contato. O componente horizontal de 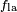 é cancelada pela força adesiva,
é cancelada pela força adesiva, 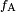 .
.
O equilíbrio mais revelador de forças, no entanto, é, na direcção vertical. A componente vertical da 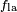 deve cancelar exatamente a força,
deve cancelar exatamente a força, 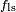 .
.
| Líquido | Sólido | Ângulo de contato | |||
|---|---|---|---|---|---|
| água |
| 0 ° | |||
| etanol | |||||
| éter dietílico | |||||
| tetracloreto de carbono | |||||
| glicerina | |||||
| ácido acético | |||||
| água | cera de parafina | 107 ° | |||
| prata | 90 ° | ||||
| iodeto de metilo | vidro de soda-lime | 29 ° | |||
| vidro de chumbo | 30 ° | ||||
| quartzo fundido | 33 ° | ||||
| mercúrio | vidro de soda-lime | 140 ° | |||
| Alguns ângulos de contacto líquido-sólido | |||||
Uma vez que as forças estão em proporção direta com seus respectivos tensões superficiais, temos também:
onde
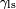 é a tensão de superfície sólido-líquido,
é a tensão de superfície sólido-líquido,  é a tensão superficial do líquido-ar,
é a tensão superficial do líquido-ar,  é o ângulo de contacto, onde uma côncava menisco tem ângulo de menos de 90º e um convexo menisco tem ângulo de contacto maior do que 90 °.
é o ângulo de contacto, onde uma côncava menisco tem ângulo de menos de 90º e um convexo menisco tem ângulo de contacto maior do que 90 °.
Isto significa que, embora a tensão da superfície sólido-líquido,  , É difícil medir diretamente, se pode inferir a partir do ângulo de contato facilmente medido,
, É difícil medir diretamente, se pode inferir a partir do ângulo de contato facilmente medido,  , Se a tensão superficial do líquido-ar,
, Se a tensão superficial do líquido-ar,  , É conhecido.
, É conhecido.
Existe a mesma relação no diagrama à direita. Mas, neste caso, vemos que por causa do ângulo de contato é inferior a 90 °, a tensão líquida / superfície sólida deve ser negativa:
Ângulos de contato especiais
Observa-se que, no caso especial de uma interface água-prata, onde o ângulo de contacto é igual a 90 °, a tensão da superfície sólido-líquido é exactamente zero. É difícil para limpar o chão se líquidos com contacto derrames ângulo ≈ 0 °, como gasolina, querosene, benzeno, etc.
Outro caso especial é o lugar onde o ângulo de contato é exatamente 180 °. Água com especialmente preparado Teflon® se aproxima deste. Ângulo de contacto de 180 ° ocorre quando a tensão da superfície sólido-líquido é exactamente igual à tensão superficial do líquido-ar.
Métodos de medição
Porque a tensão superficial se manifesta em vários efeitos, oferece um número de caminhos para a sua medição. Qual o método é óptima depende da natureza do líquido a ser medido, as condições em que a sua tensão é para ser medida, e a estabilidade da sua superfície quando é deformada.
- Du Nouy Anel método: O método tradicional usado para medir a superfície ou tensão interfacial. Propriedades de umectação da superfície ou interface têm pouca influência sobre essa técnica de medição. A máxima tracção exercida sobre o anel de superfície é medido.
- Uma versão em miniatura de Du Nouy método utiliza uma pequena agulha com diâmetro de metal em vez de um anel, em combinação com uma microbalança de alta sensibilidade para gravar máximo de puxar. A vantagem deste método é que volumes de amostra muito pequenos (menos de algumas dezenas de microlitros) podem ser medidas com uma precisão muito elevada, sem a necessidade de corrigir a flutuabilidade (por uma agulha ou melhor, da haste, com uma geometria apropriada). Além disso, a medição pode ser realizada muito rapidamente, minimamente em cerca de 20 segundos. Primeira tensiômetros multicanal comerciais [CMCeeker] foram recentemente construído com base nesse princípio.
- Wilhelmy método da placa: Um método universal especialmente adequado para verificar a tensão superficial em intervalos de tempo longos. Uma placa vertical do perímetro conhecido está ligada a um contrapeso, e a força, devido ao humedecimento é medido.
- Método da gota Spinning: Esta técnica é ideal para medir baixas tensões interfaciais. O diâmetro de uma gota no interior de uma fase pesada é medido quando ambos são rodados.
- Método de gota pendente: tensão superficial e interfacial pode ser medida por esta técnica, mesmo a temperaturas e pressões elevadas. Geometria de uma gota é analisado opticamente. Para mais detalhes, consulte Solta.

- Método da bolha de pressão (método de Jaeger): Uma técnica de medida para a determinação da tensão superficial em idades de superfície curtas. A pressão máxima de cada bolha é medido.
- Gota método de volume: Um método para determinar a tensão interfacial como uma função da idade da interface. Líquido de uma densidade é bombeada para um segundo líquido com uma densidade diferente e tempo entre as quedas é medida produzidos.
- Método de ascensão capilar: A extremidade de um capilar é imerso na solução. A altura em que a solução atinja no interior do capilar está relacionada com a tensão superficial pela equação discutida abaixo .
- Método Stalagmometric: Um método de ponderação e lendo uma gota de líquido.
- Método da gota séssil: Um método para determinar a tensão superficial e densidade colocando uma gota sobre um substrato e medindo a ângulo de contato (ver Técnica da gota séssil).
Efeito
Líquido de um tubo vertical
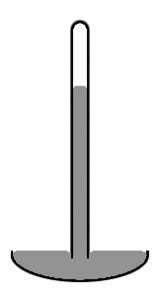
Um estilo antigo de mercúrio barómetro consiste de um tubo vertical de vidro de cerca de 1 cm de diâmetro parcialmente cheio com mercúrio, e com um vácuo (chamado de vácuo Toricelli) no volume não preenchido (ver diagrama da direita). Note-se que o nível de mercúrio no centro do tubo é maior do que nas arestas, tornando a superfície superior da forma de cúpula-mercúrio. O centro de massa de toda a coluna de mercúrio seria um pouco mais baixo, se a superfície superior do mercúrio foram plana ao longo de todo o Crossection do tubo. Mas a parte superior em forma de cúpula dá ligeiramente menos área de superfície para a massa inteira de mercúrio. Mais uma vez os dois efeitos combinam-se para minimizar a energia potencial total. Uma tal forma da superfície é conhecido como um convexa menisco.
A razão pela qual se considera a área de superfície de toda a massa de mercúrio, incluindo a parte da superfície que está em contacto com o vidro, é porque o mercúrio não adere de todo ao vidro. Portanto, a tensão superficial do mercúrio actua sobre toda a sua superfície, incluindo, quando está em contacto com o vidro. Se em vez de vidro, o tubo eram feitas de cobre, a situação seria muito diferente. Mercury adere agressivamente para cobre. Assim, em um tubo de cobre, o nível de mercúrio no centro do tubo será inferior, em vez de mais elevada do que nas arestas (isto é, seria um menisco côncavo). Numa situação em que o líquido adira às paredes do seu recipiente, consideramos a parte da área da superfície do fluido que está em contacto com o recipiente ter tensão superficial negativa. O fluido em seguida, funciona para maximizar a área da superfície de contacto. Portanto, neste caso aumentando a área em contacto com as diminuições de contentores em vez de aumentar a energia potencial. Essa diminuição é o suficiente para compensar o aumento da energia potencial associada com elevação do fluido perto das paredes do recipiente.
Se um tubo é suficientemente estreita e a adesão líquido para as suas paredes é suficientemente forte, a tensão superficial pode aspirar o líquido para cima no tubo num fenómeno conhecido como acção capilar. A altura da coluna é levantada a é dada por:
onde
 representa a altura do líquido é elevado,
representa a altura do líquido é elevado,  é a tensão superficial do líquido-ar,
é a tensão superficial do líquido-ar,  é a densidade do líquido,
é a densidade do líquido,  é o raio do capilar,
é o raio do capilar,  é a aceleração devido à gravidade,
é a aceleração devido à gravidade,  é o ângulo de contacto descritas acima. Note-se que se
é o ângulo de contacto descritas acima. Note-se que se  é maior do que 90 °, como com mercúrio num recipiente de vidro, o líquido vai ser pressionado em vez de suspenso.
é maior do que 90 °, como com mercúrio num recipiente de vidro, o líquido vai ser pressionado em vez de suspenso.
Poças em uma superfície
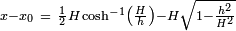 onde
onde 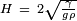

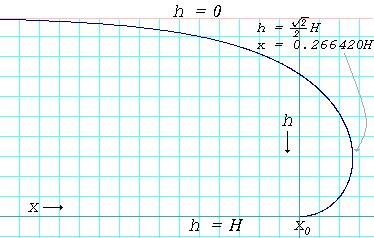
Mercúrio Verteu-se em uma folha plana horizontal dos resultados de vidro numa poça que tem uma espessura perceptível (não tente fazer isso a não ser sob uma exaustor. Vapor de mercúrio é um risco tóxico). A poça vai espalhar-se apenas ao ponto onde é um pouco menos de meio centímetro de espessura, e não mais fino. Novamente, isto é devido à ação de forte tensão superficial de mercúrio. A massa líquida achata porque isso traz como grande parte do mercúrio para um nível tão baixo quanto possível. Mas a tensão superficial, ao mesmo tempo, está a actuar para reduzir a área de superfície total. O resultado é o comprometimento de uma poça de espessura quase fixo.
O mesmo demonstração tensão superficial pode ser feita com água, mas somente sobre uma superfície feita de uma substância que a água não aderir. Wax é uma tal substância. Água vertida sobre uma superfície de cera lisa, plana, horizontal, dizer uma folha encerado de vidro, irá se comportar de forma semelhante ao mercúrio derramado em vidro.
A espessura de uma poça de líquido sobre uma superfície, cujo ângulo de contacto é de 180 ° C é dada por:
onde
 é a profundidade da poça em centímetros ou metros.
é a profundidade da poça em centímetros ou metros.  é a tensão superficial do líquido em dines por centímetro ou newtons por metro.
é a tensão superficial do líquido em dines por centímetro ou newtons por metro.  é a aceleração devido à gravidade e é igual a 980 centímetros / s 2 ou 9,8 m / s 2
é a aceleração devido à gravidade e é igual a 980 centímetros / s 2 ou 9,8 m / s 2  é a densidade do líquido, em gramas por centímetro cúbico ou quilogramas por metro cúbico
é a densidade do líquido, em gramas por centímetro cúbico ou quilogramas por metro cúbico

Na realidade, as espessuras das poças será ligeiramente menos do que o que é previsto pela fórmula acima, porque muito poucas superfícies têm um ângulo de contacto de 180 ° com qualquer líquido. Quando o ângulo de contacto é inferior a 180 °, a espessura é dada por:
Para mercúrio em vidro, 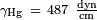 ,
, 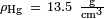 E
E 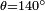 , O que dá
, O que dá 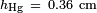 . Para a água em parafina a 25 ° C,
. Para a água em parafina a 25 ° C, 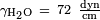 ,
, 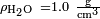 E
E 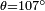 que dá
que dá 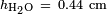 .
.
A fórmula também prevê que, quando o ângulo de contacto é de 0 °, o líquido irá espalhar-se em uma camada de micro-fino sobre a superfície. Uma tal superfície é dito ser totalmente molhável pelo líquido.
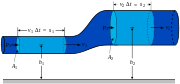
A ruptura dos fluxos em gotas
 , Onde
, Onde 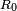 é o raio do fluxo não perturbado,
é o raio do fluxo não perturbado, 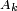 é a amplitude da perturbação,
é a amplitude da perturbação,  é a distância ao longo do eixo da corrente, e
é a distância ao longo do eixo da corrente, e  é o número de onda
é o número de onda No dia-a-dia todos nós observamos que um fluxo de água saindo de uma torneira vai dividir-se em gotas, não importa o quão bem o fluxo é emitido a partir da torneira. Isto é devido a um fenômeno chamado a A instabilidade Rayleigh-planalto, que é inteiramente uma consequência do efeito de tensão superficial.
A explicação para esta instabilidade começa com a existência de pequenas perturbações no fluxo. Estes estão sempre presentes, não importa quão suave é o fluxo. Se as perturbações são resolvidos nos componentes senoidais, verificamos que alguns componentes crescer com o tempo, enquanto outros se deteriorar com o tempo. Entre aqueles que crescem com o tempo, alguns crescer a taxas mais rápidas do que os outros. Se um componente decai ou cresce, e a velocidade com que cresce é inteiramente uma função do número de onda (uma medida de como muitas picos e depressões por centímetro) e o raio do fluxo original é cilíndrica. O diagrama à direita mostra um exagero de um único componente.
Ao assumir que todos os componentes possíveis existe inicialmente em amplitudes aproximadamente iguais (mas minúsculas), o tamanho das gotas finais pode ser previsto através da determinação de um número que cresce o componente mais rápido onda. Como o tempo passa, é o componente cuja taxa de crescimento é máximo que virá a dominar e acabará por ser aquela que aperta o fluxo em gotas.
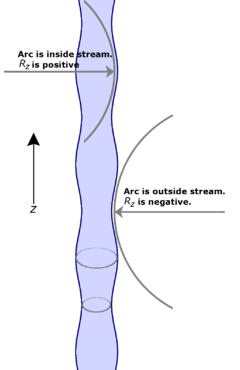
Embora um entendimento completo de como isso acontece requer um desenvolvimento matemático (ver referências), o diagrama pode fornecer uma compreensão conceitual. Observar as duas bandas mostrados anelamento o fluxo - um de cada pico e a outra a uma calha da onda. Na calha, o raio do fluxo é menor, por conseguinte, de acordo com o Equação de Young-Laplace (discutido acima), a pressão, devido à tensão superficial é aumentada. Da mesma forma no pico o raio do fluxo é maior e, pela mesma razão, a pressão, devido à tensão superficial é reduzida. Se este fosse o único efeito, seria de esperar que a maior pressão na calha seria espremer líquido para a região de pressão mais baixa no pico. Desta forma, vemos como a onda cresce em amplitude ao longo do tempo.
Mas o Equação de Young-Laplace é influenciado por dois componentes separados raio. Neste caso é o raio, já discutido, do próprio fluxo. A outra é o raio de curvatura da onda em si. Os arcos embutidos no diagrama mostrar estes em um pico e em uma calha. Observa-se que o raio de curvatura da calha é, de facto, negativo, o que significa que, de acordo com Young-Laplace, que, na verdade, diminui a pressão na calha. Do mesmo modo o raio de curvatura do pico é positivo e aumenta a pressão nessa região. O efeito destes componentes está em frente aos efeitos do raio da própria corrente.
Os dois efeitos, em geral, não exactamente cancelar. Um deles terá maior magnitude do que o outro, dependendo do número de onda e o raio inicial do córrego. Quando o número de onda é de tal modo que o raio de curvatura da onda dominante de que o raio do fluxo, tais componentes decairá ao longo do tempo. Quando o efeito do raio do fluxo que domina da curvatura da onda, tais componentes crescer exponencialmente com o tempo.
Quando toda a matemática é feita, verificou-se que os componentes instáveis (isto é, componentes que crescem ao longo do tempo) são apenas aqueles em que o produto do número de onda com o raio inicial é menor que a unidade ( 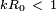 ). O componente que cresce o mais rápido é aquele cujo número de onda satisfaz a equação:
). O componente que cresce o mais rápido é aquele cujo número de onda satisfaz a equação:
Termodinâmica
Como indicado acima, o trabalho mecânico necessário para aumentar uma superfície é 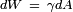 . Daí a temperatura e pressão constante, tensão superficial igual a energia livre de Gibbs por área de superfície:
. Daí a temperatura e pressão constante, tensão superficial igual a energia livre de Gibbs por área de superfície:
onde  é energia livre de Gibbs e
é energia livre de Gibbs e 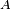 é a área.
é a área.
Termodinâmica requer que todas as mudanças espontâneas de estado são acompanhados por uma diminuição da energia livre de Gibbs.
A partir disto, é fácil compreender porque a diminuição da área de superfície de uma massa de líquido é sempre espontânea ( 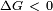 ), Desde que não esteja acoplado a quaisquer outras alterações de energia. Segue-se que, a fim de aumentar a área de superfície, uma certa quantidade de energia deve ser adicionado.
), Desde que não esteja acoplado a quaisquer outras alterações de energia. Segue-se que, a fim de aumentar a área de superfície, uma certa quantidade de energia deve ser adicionado.
Energia livre de Gibbs é definida pela equação, 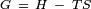 , Onde
, Onde  é entalpia e
é entalpia e  é entropia . Com base nesta e o facto de que a tensão superficial é energia livre de Gibbs por unidade de área, que é possível obter a seguinte expressão para a entropia por unidade de área:
é entropia . Com base nesta e o facto de que a tensão superficial é energia livre de Gibbs por unidade de área, que é possível obter a seguinte expressão para a entropia por unidade de área:
Kelvin Equação para superfícies surge reorganizando as equações anteriores. Ele afirma que entalpia ou energia de superfície da superfície (diferente de energia livre de superfície) depende tanto da tensão de superfície e o seu derivado com a temperatura a pressão constante por a relação.
Influência da temperatura
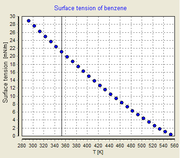
A tensão superficial é dependente da temperatura. Por esse motivo, quando um valor é determinado para a tensão superficial de uma interface, a temperatura deve ser mencionado explicitamente. A tendência geral é que a tensão superficial diminui com o aumento da temperatura, atingindo um valor de 0 a temperatura crítica. Para mais detalhes veja Regra Eötvös. Há equações única empíricos para relacionar a tensão superficial e temperatura:
- Eötvös:
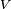 é o volume molar da substância
é o volume molar da substância  é o temperatura crítica
é o temperatura crítica  é uma constante para cada uma das substâncias.
é uma constante para cada uma das substâncias.
Por exemplo, para água k = 1,03 erg / ° C (103 nJ / K ), V = 18 ml / mol e C T = 374 ° C.
Uma variante Eötvös é descrito por Ramay e Shields:
onde o deslocamento de 6 graus Kelvin temperatura proporciona a fórmula com um melhor ajuste à realidade a temperaturas mais baixas.
- Guggenheim-Katayama:
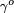 é uma constante para cada líquido e n é um factor empírico, cujo valor é 11/9 para líquidos orgânicos. Esta equação também foi proposta por van der Waals, que ainda propôs que
é uma constante para cada líquido e n é um factor empírico, cujo valor é 11/9 para líquidos orgânicos. Esta equação também foi proposta por van der Waals, que ainda propôs que 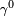 Pode ser dada pela expressão,
Pode ser dada pela expressão, 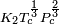 , Onde
, Onde 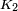 é uma constante universal para todos os líquidos, e
é uma constante universal para todos os líquidos, e 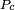 é o pressão crítica do líquido (embora experimentos posteriores encontrado
é o pressão crítica do líquido (embora experimentos posteriores encontrado 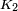 a variar em algum grau a partir de um líquido para o outro).
a variar em algum grau a partir de um líquido para o outro).
Ambos Guggenheim-Katayama e Eötvös levar em conta o fato de que a tensão superficial chega a 0 na temperatura crítica, enquanto Ramay e Shields não corresponde à realidade neste endpoint.
Influência da concentração de soluto
Os solutos podem ter diferentes efeitos sobre a tensão de superfície em função da sua estrutura:
- Nenhum efeito, por exemploaçúcar
- Aumento da tensão superficial,sais inorgânicos
- Diminuir a tensão superficial progressivamente,álcoois
- Diminuir a tensão superficial e, uma vez que é atingido um mínimo, não mais do efeito: surfactantes
O que complica o efeito é que um soluto podem existir em uma concentração diferente na superfície de um solvente do que na sua maior parte. Esta diferença varia de um soluto / combinação solvente para outro.
Gibbs isotérmica afirma que: 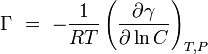
 é conhecido como a concentração de superfície, que representa o excesso de soluto por unidade de área da superfície sobre o que estaria presente se a concentração de grandes quantidades prevaleceu todo o caminho até à superfície. Possui unidades de mol / m 2
é conhecido como a concentração de superfície, que representa o excesso de soluto por unidade de área da superfície sobre o que estaria presente se a concentração de grandes quantidades prevaleceu todo o caminho até à superfície. Possui unidades de mol / m 2
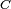 é a concentração da substância em solução em massa.
é a concentração da substância em solução em massa.
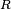 é o constante de gás e
é o constante de gás e 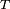 a temperatura
a temperatura
Certas hipóteses estão no seu dedução feita, por conseguinte, Gibbs isotérmica só pode ser aplicado a soluções ideais (muito diluídas) com dois componentes.
Influência do tamanho de partícula sobre a pressão de vapor
O Relação Clausius-Clapeyron leva a outra equação também atribuída a Kelvin. Isso explica por que, por causa da tensão superficial, o pressão de vapor de pequenas gotículas de líquido em suspensão é maior do que a pressão de vapor que mesmo padrão de líquido quando a interface é plana. Isto quer dizer que, quando um líquido se está a formar pequenas gotículas, a concentração de equilíbrio do seu vapor nas suas imediações é maior. Isto surge porque a pressão no interior da gotícula é maior do que no exterior.
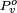 representa a pressão de vapor para o padrão que o líquido a esta temperatura e pressão.
representa a pressão de vapor para o padrão que o líquido a esta temperatura e pressão.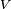 é o volume molar.
é o volume molar.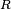 é o constante de gás
é o constante de gás
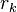 é o raio Kelvin, o raio das gotículas.
é o raio Kelvin, o raio das gotículas.
O efeito explica supersaturação de vapores. Na ausência de locais de nucleação, tem de formar pequenas gotículas antes de poderem evoluir em gotas maiores. Isto requer uma pressão de vapor muitas vezes a pressão de vapor no ponto de transição de fase.
Esta equação é também usado emcatalisadorpara avaliar a químicamesoporosidade para os sólidos.
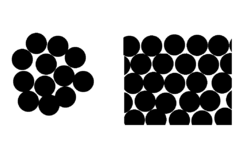
O efeito pode ser visto em termos do número médio de vizinhos moleculares de moléculas de superfície (ver figura).
A tabela mostra alguns valores calculados deste efeito para a água em diferentes tamanhos de gota:
| P/P 0para gotas de água de diferentes raios emSTP | ||||
|---|---|---|---|---|
| Raio da gota (nm) | 1000 | 100 | 10 | 1 |
| P/P 0 | 1.001 | 1.011 | 1.114 | 2.95 |
O efeito torna-se claro para tamanhos de gota muito pequenas, tal como uma gota de um raio de cerca de 100 nm, tem moléculas para dentro, que é uma quantidade pequena o suficiente para requerer ummecânica quânticaanálise.
Tabela de dados
Os dados são retirados doManual de Lange de Química, 10 ed.pp 1661-1665
| A tensão superficial de vários líquidos emdyn / cm em relação ao ar Mistura% 's são por peso | ||
|---|---|---|
| Líquido | Temperatura ° C | Tensão superficial,γ |
| Ácido acético | 20 | 27,6 |
| Ácido acético (40,1%) + Água | 30 | 40.68 |
| O ácido acético (10,0%) + Água | 30 | 54.56 |
| Acetona | 20 | 23,7 |
| Éter dietílico | 20 | 17,0 |
| Etanol | 20 | 22.27 |
| Etanol (40%) + Água | 25 | 29.63 |
| Etanol (11,1%) + Água | 25 | 46.03 |
| Glicerina | 20 | 63 |
| n-hexano | 20 | 18,4 |
| Ácido clorídrico17,7solução aquosa H | 20 | 65.95 |
| Isopropanol | 20 | 21,7 |
| Mercúrio | 15 | 487 |
| Metanol | 20 | 22,6 |
| n-octano | 20 | 21,8 |
| Cloreto de sódio 6,0 Solução aquosa H | 20 | 82,55 |
| A sacarose(55%) + água | 20 | 76.45 |
| Água | 0 | 75,64 |
| Água | 25 | 71,97 |
| Água | 50 | 67,91 |
| Água | 100 | 58.85 |